Dalle malattie rare alle malattie dimenticate: evoluzione del concetto di farmaco orfano
Programma Scienziati in Azienda - VII EdizioneStresa, 2 - 20 luglio 2007
Project Work
A cura di: Mariapaola Focà, Nicoletta Iossa, Rachele Morosi, Olga Pellegrino, Paola Sabattini, Massimo Strocchi
Scarica il file pdf
Introduzione
Farmaci orfani: una definizione
La definizione classica di farmaco orfano fa riferimento a quei prodotti che sono potenzialmente utili nel trattamento di una malattia rara, ma non hanno mercato sufficiente per ripagare le spese del proprio sviluppo. Rimangono pertanto senza sponsor e quindi “orfani” (www.iss.it).La ragione della scarsa redditività del mercato è quindi rappresentata dall’incidenza con la quale le malattie rare si manifestano, benché ad oggi ne siano state identificate tra i 5000 e i 6000 tipi ed ogni anno ne vengano descritte 250 di nuove.
Dati recenti riportano che 25 milioni di persone nel Nord America e 30 milioni in Europa sono affette da una di queste patologie (Wastfelt et al., 2006), e che la maggioranza dei pazienti è costituita da bambini, per un terzo dei quali si registra il decesso nel primo anno di vita (Crompton, 2002).
La maggior parte di tali malattie, spesso croniche, progressive e debilitanti, ha un’origine genetica (70-80%), mentre la restante parte è causata da infezioni, disturbi allergici e autoimmuni, avvelenamento e cause sconosciute (Rinaldi, 2005).
I farmaci orfani possono quindi essere definiti come farmaci non distribuiti dall’industria farmaceutica ma che rispondono ad un bisogno di salute pubblica (www.orpha.net).
A tutela di questo bisogno, nell’intento di promuovere lo sviluppo di tali farmaci a garanzia dell’equità nell’accesso ai trattamenti, i paesi industrializzati hanno introdotto specifiche misure di supporto, per le quali sono stati definiti i criteri economici e/o epidemiologici per la designazione dello stato di “orfano” ed una conseguente serie di incentivi per promuovere la ricerca su questo tipo di farmaci a livello industriale. Dopo l’entrata in vigore dell’Orphan Drug Act negli USA (1983), in Giappone (1993), Australia (1997) e successivamente nell’Unione Europea (2000) sono state approvate leggi per incentivare le compagnie farmaceutiche e biotecnologiche ad investire nella ricerca sui farmaci orfani attraverso agevolazioni fiscali ed esclusività di mercato come descritto più specificamente nelle pagine seguenti.
Quadro normativo
Legislazione statunitense: Orphan Drug Act e successive modificheNegli ultimi venti anni, l’industria farmaceutica statunitense ha mostrato un certo interesse nello sviluppo di nuovi medicinali per il trattamento di patologie rare (orfane).
Questo impegno affonda le sue origini nell’approvazione da parte del Congresso degli Stati Uniti d’America dell’Orphan Drug Act (ODA). Firmata dal presidente Reagan nel gennaio 1983, tale legge affermava per la prima volta che lo Stato avrebbe appoggiato con una serie di interventi lo sviluppo di nuovi trattamenti per la cura di malattie rare (Haffner, 2003).
Fino a quel momento le malattie rare, con la loro limitata popolazione di pazienti, non erano considerate di alcun interesse da parte delle aziende farmaceutiche, che erano consapevoli di non poter recuperare i costi di ricerca e sviluppo con le vendite di un farmaco appartenente alla categoria degli orfani. Non si effettuava ricerca sui farmaci orfani, oppure una volta scoperta una molecola interessante non venivano condotti i necessari studi clinici richiesti dall’FDA per poter ottenere l’approvazione all'immissione in commercio. Quindi il farmaco rimaneva orfano.
Un altro disincentivo allo sviluppo di tali farmaci era determinato dall’impossibilità di brevettare la maggior parte delle molecole sviluppate: di conseguenza il produttore di un farmaco orfano si sarebbe trovato in competizione con prodotti generici. Lo scarso interesse da parte delle aziende farmaceutiche in questo campo era in fondo dettato dalla legge di domanda e offerta: seguito alla scarsa domanda di un certo farmaco orfano, il prezzo dello stesso avrebbe dovuto essere particolarmente elevato, tanto da superare in fretta le possibilità economiche dei singoli individui e il limite di copertura delle polizze assicurative sulla salute.
Era chiaro che in mancanza di determinati incentivi sia sul piano economico che sul piano regolatorio, le industrie farmaceutiche non avrebbero investito nel campo dei farmaci orfani.
L’Orphan Drug Act quindi nasceva con l’intento di incoraggiare la ricerca, lo sviluppo e la commercializzazione di farmaci orfani destinati al trattamento di malattie rare (Rohde, 2001). Tale legislazione stabiliva di accordare la designazione di medicinale orfano a qualsiasi farmaco in grado di trattare una malattia o condizione rara. Per ottenere tale designazione, lo sponsor doveva dimostrare che le spese sostenute per lo sviluppo di un certo farmaco non sarebbero state recuperate con le vendite dello stesso.
Questo imponeva alle industrie farmaceutiche la presentazione all’FDA di costose e dettagliate analisi economico-finanziarie a supporto della richiesta di designazione. Nel primo anno di applicazione della legge furono presentate solo 15 richieste di designazione (di queste 10 vennero effettivamente concesse). Una volta ottenuta la designazione, il farmaco orfano poteva e può a tutt’oggi beneficiare di una serie di incentivi:
- finanziamenti statali per l’effettuazione degli studi clinici (da $200.000 a $350.000 per anno fino ad un massimo di 3 anni; dati relativi agli anni 2007-2008);
- tagli del 50% sulla tassazione imposta sui costi degli studi clinici;
- esclusività di mercato della durata di 7 anni dalla data di approvazione all’immissione in commercio concessa dall’FDA;
- assistenza nella stesura dei protocolli di sviluppo dei farmaci.
Da ricordare infine che con l’ODA è stato istituito presso l’FDA l’Ufficio per lo Sviluppo dei Prodotti Orfani (Office of Orphan Products Development, OOPD). Qualsiasi sponsor che voglia richiedere la designazione di orfano per un certo farmaco o prodotto biologico deve presentare la domanda all’OOPD. Tale ufficio gestisce il programma di incentivi previsti dalla legislazione.
Il Congresso intervenne nel 1984 con un emendamento che inseriva un valore di prevalenza numerica per definire una malattia o condizione come rara (Congressional Research Service Report, Villareal, 2001). Fu stabilito che per ottenere lo status di farmaco orfano, una malattia o condizione rara doveva:
- colpire meno di 200.000 persone negli Stati Uniti;
- oppure più di 200.000 persone, ma con previsioni di vendita del farmaco indicanti l’impossibilità di recuperare i costi di sviluppo attraverso le vendite.
Nel 1985 la legge fu nuovamente emendata per estendere il periodo di esclusività di mercato anche a prodotti coperti da brevetti. Infatti, al contrario di quanto si credeva inizialmente, molti potenziali farmaci orfani erano stati brevettati, ma a causa dei tempi necessari per lo sviluppo i brevetti erano scaduti prima che il prodotto fosse pronto per il mercato. E’ comunque necessario chiarire che l’esclusività ha un’accezione più ristretta del brevetto: infatti si riferisce solamente alla designazione terapeutica assegnata ad un determinato prodotto ed un’altra azienda potrebbe richiedere la designazione per lo stesso identico medicinale ma per una diversa indicazione terapeutica. Inoltre l’esclusività viene a cadere nel momento in cui il produttore non sia in grado di soddisfare le richieste di mercato, decide di interrompere la produzione o acconsenta ad una “esclusività condivisa” con un altro produttore.
Nel 1988 un ulteriore emendamento specificò che prima di richiedere l’approvazione all’immissione in commercio, un farmaco dovesse già possedere la designazione di "orfano", requisito che in precedenza poteva essere richiesto in qualsiasi momento antecedente l’ottenimento dell’approvazione all’immissione in commercio.
Nel 1997 il Congresso approvò un nuovo incentivo dispensando le aziende che sviluppavano farmaci orfani dal pagamento delle spese amministrative dovute all’FDA al momento della richiesta di approvazione alla commercializzazione di un prodotto orfano. Questa tassa, attualmente, ammonta a $896.200 per un medicinale che necessita di ulteriori dati clinici prima di poter essere approvato, oppure a $448.100 per un medicinale che non necessita di ulteriore dati clinici a supporto della richiesta (Federal Register, Vol. 71, N. 148, 02/08/2006).
Nello stesso anno è stato emanato il Food and Drug Administration Modernization Act (FDAMA) che comprendeva norme destinate alla regolamentazione dei farmaci orfani per uso pediatrico. La legge riconosceva i pazienti pediatrici come “orfani terapeutici”, in base alla constatazione che molti farmaci presenti sul mercato mancavano di adeguate informazioni riguardo i dosaggi da utilizzare sui bambini. Fino ad allora la legge stabiliva che uno sponsor potesse chiedere la designazione di medicinale orfano per un farmaco in fase di sviluppo purché fosse destinato ad un sottogruppo di pazienti affetti da una determinata patologia.
Tale richiesta risultava giustificata purché il sottogruppo fosse nettamente classificabile e individuabile da un punto di vista medico (“medically plausible”). Fu stabilito che i pazienti pediatrici avessero tutte le caratteristiche per poter rappresentare un sottogruppo significativo. La richiesta di designazione per uso pediatrico, deve comunque soddisfare i requisiti di prevalenza della malattia stabiliti con l’emendamento all’ODA del 1984.
Una volta ottenuta la designazione, lo sponsor ha diritto a richiedere gli incentivi previsti dalla legislazione che regola i medicinali orfani.
Politica sui farmaci orfani in Europa
L'Unione Europea ha preso spunto da quanto fatto negli Stati Uniti e nel 1999 ha istituito una politica per i farmaci orfani unica per i 15 Stati membri.
È stato intrapreso uno sforzo sia a livello europeo che nazionale dalle industrie e dalle autorità della salute (European Agency for the Evaluation of Medicinal Products, EMEA), al fine di offrire gli incentivi necessari per stimolare lo sviluppo dei farmaci orfani e l'ottenimento di una Autorizzazione alla Commercializzazione (AIC) attraverso una procedura centralizzata.
L'obiettivo è quello di disporre rapidamente, per le patologie rare, dei farmaci con un livello di qualità equivalente a quello richiesto per qualsiasi altro farmaco.
Va evidenziato che l'Europa, principalmente a causa del frazionamento del suo territorio e della dispersione delle competenze in materia sanitaria, ha tardato nell'adozione di una politica unica sui farmaci orfani.
Nel dicembre 1999, il Parlamento Europeo e il Consiglio hanno adottato il regolamento (CE) N.141/2000 riguardante i farmaci orfani. Ampiamente ispirato dal regolamento degli Stati Uniti, ha come obiettivi quelli di:
- istituire una procedura comunitaria per l'assegnazione della qualifica di medicinali orfani;
- offrire incentivi per la ricerca, lo sviluppo e l'immissione in commercio dei medicinali orfani così qualificati, in modo da incitare le industrie farmaceutiche e biotecnologiche a sviluppare e a commercializzare tali farmaci e gli Stati membri a prendere provvedimenti analoghi e/o complementari a livello nazionale;
- creare un comitato dei farmaci orfani (Committee for Orphan Medical Products, COMP) istituito all'interno dell'Agenzia Europea per i Farmaci (EMEA), incaricata di esaminare le richieste di designazione e di consigliare e assistere la Commissione nelle discussioni relative ai farmaci orfani.
Tale regolamento definisce anzitutto i criteri per l’assegnazione della qualifica di “orfano” ad un medicinale e stabilisce che (art.3 paragrafo 1):
“Un medicinale è qualificato come medicinale orfano qualora il suo sponsor sia in grado di dimostrare:
- che esso è destinato alla diagnosi, alla profilassi o alla terapia di un’affezione che comporta una minaccia per la vita o la debilitazione cronica e che colpisce non più di cinque individui su diecimila nella Comunità, oppure che esso è destinato alla diagnosi, alla profilassi o alla terapia nella Comunità di un’affezione che comporta una minaccia per la vita, di un'affezione seriamente debilitante, o di un'affezione grave e cronica, e che è poco probabile che, in mancanza di incentivi, la commercializzazione di tale medicinale all'interno della Comunità sia tanto redditizia da giustificare l'investimento necessario;
- che non esistono metodi soddisfacenti di diagnosi, profilassi o terapia di tale affezione autorizzati nella Comunità oppure che, se tali metodi esistono, il medicinale in questione avrà effetti benefici significativi per le persone colpite da tale affezione.”
Analisi dei principali incentivi diretti introdotti dal regolamento CE 141/2000
Definizione di una procedura di designazione per i medicinali orfani.
La designazione di un prodotto in quanto medicinale orfano può venir richiesta mediante domanda rivolta all’EMEA. La suddetta designazione rende possibile una rinuncia al percepimento dei canoni relativi alla procedura di autorizzazione alla commercializzazione, inclusi quelli destinati a pagare l’assistenza protocollare, la consulenza scientifica, l’autorizzazione alla commercializzazione vera e propria, le ispezioni, i rinnovi.
Approvazione della privativa decennale sulla commercializzazione.
Rappresenta la chiave di volta del regolamento e si fonda sulla designazione di un prodotto in quanto medicinale orfano. È parere unanime che la privativa commerciale costituisca la chiave di volta di qualsiasi sistema d’incentivi riguardante le attività di ricerca e sviluppo sui medicinali orfani: nel regolamento essa viene concessa soltanto quando il medicinale in questione è stato designato come orfano e la Comunità oppure tutti i 15 Stati membri hanno rilasciato l’autorizzazione a commercializzarlo.
La privativa, così accordata, impedisce alla Comunità o ad uno Stato membro di rilasciare in un secondo momento l’autorizzazione a commercializzare un medicinale analogo (basato ad esempio sullo stesso principio attivo) con le stesse indicazioni terapeutiche. Essa non impedisce la commercializzazione di un altro prodotto che abbia le stesse indicazioni terapeutiche, ma diverso principio attivo.
Assistenza protocollare.
Consiste nel fornire la consulenza scientifica ai potenziali richiedenti di un’autorizzazione alla commercializzazione per quanto riguarda lo svolgimento delle varie prove e collaudi necessari a dimostrare qualità, sicurezza ed efficacia del prodotto.
Autorizzazione comunitaria a commercializzare un medicinale orfano.
Tale autorizzazione (rilasciata dalla Comunità nell’ambito della cosiddetta "procedura centralizzata") rappresenta il modo più semplice e rapido per commercializzare un medicinale nell’intera Comunità, agevolando l’accesso a questa procedura per i medicinali orfani.
Istituzione di un Comitato per i Medicinali Orfani (Committee for Orphan Medicinal Products, COMP).
Costituito da 21 rappresentanti: uno per ogni stato membro, tre rappresentanti di associazioni dei pazienti e tre membri proposti dall'EMEA. Questo è il comitato cui spetta la responsabilità di svolgere gli esami scientifici che portano a designare come orfano un medicinale. Il COMP ha cominciato ad operare nell’aprile 2000 e nel corso della sua attività ha individuato esperti per specifiche malattie orfane, l’attività dei quali si prefigge lo scopo di aumentare le conoscenze europee in tema di malattie rare, nell’intento di acquisire la possibilità di far loro riferimento nel corso di una successiva valutazione di prodotti specifici oppure di fornire consulenze scientifiche o assistenza protocollare.
Riprendendo l’art. 3 del Regolamento 141/2000, la Commissione ha successivamente adottato il Regolamento (CE) N. 847/2000, del 27 aprile 2000, che stabilisce le disposizioni di applicazione dei criteri previsti per l'assegnazione della qualifica di medicinale orfano nonché la definizione dei concetti di medicinale "simile" e "clinicamente superiore".
La Commissione ha inteso definire la propria posizione in merito ad alcuni punti relativi all'attuazione delle disposizioni in materia di assegnazione della qualifica e dell’esclusiva di mercato. Tali interpretazioni si prefiggono di fornire un orientamento all'Agenzia europea di valutazione dei medicinali, agli Stati membri, all'industria farmaceutica ed alle altre parti interessate. In particolare gli articoli del Regolamento 847/2000 sono volti ad ampliare i criteri di assegnazione della qualifica già presenti nell’Art. 3 del Regolamento 141/2000.
Per quanto riguarda i prodotti destinati alla diagnosi o alla profilassi di un'affezione viene specificato che “la documentazione deve comprendere riferimenti autorevoli allegati, se disponibili, comprovanti che la malattia o affezione per la quale è prevista la somministrazione del medicinale colpisce non più di 5 individui su 10000 nella Comunità all’epoca in cui è presentata la domanda di qualifica” e che “i dati devono comprendere una descrizione dettagliata dell’affezione da curare, supportata dalla letteratura scientifica o medica comprovante che essa comporta una minaccia per la vita o la debilitazione cronica”.
Facendo poi riferimento alla prevalenza di una patologia al di fuori della Comunità, l'articolo 3, paragrafo 1, lettera a) del regolamento indica che, perché le patologie siano considerate come orfane, esse devono colpire “non più di cinque individui su diecimila nella Comunità”. Dato che nel regolamento ci si riferisce unicamente al numero di persone colpite nell'ambito della Comunità, la prevalenza della malattia o dell'affezione al di fuori della Comunità non ha alcuna influenza sull'interpretazione di tali criteri. Un medicinale destinato a curare un'affezione quale la malaria, che colpisce un gran numero di persone in certi paesi, ma che ha una prevalenza bassa nella Comunità europea, è quindi ammissibile che ottenga l'assegnazione della qualifica di medicinale orfano rispetto al criterio di prevalenza e, se tutti gli altri criteri sono soddisfatti, può usufruire dei benefici fissati nel regolamento.
Un altro punto da analizzare riguarda il “metodo soddisfacente autorizzato nella Comunità”: la prima alternativa all'articolo 3, paragrafo 1, lettera b), dispone che lo sponsor deve dimostrare “che non esistono metodi soddisfacenti di diagnosi, profilassi o terapia di tale affezione autorizzati nella Comunità”. Per garantire la coerenza dell'applicazione ed aiutare i richiedenti a fornire motivi giustificativi appropriati, si ritiene importante chiarire la nozione di metodo “soddisfacente”. In questo contesto, nel Regolamento (CE) N. 847/2000 della Commissione si richiede alla persona interessata di fornire particolari circa i “metodi esistenti, che possono comprendere medicinali già autorizzati, dispositivi medici o altri metodi di diagnosi, prevenzione o terapia in uso nella Comunità”.
L’ultimo ampliamento dell’art. 3, paragrafo 1, lettera b) riguarda il beneficio significativo. Si legge infatti che, ove esistano metodi soddisfacenti di diagnosi, profilassi o terapia di tale affezione, lo sponsor deve dimostrare “che il medicinale in questione avrà effetti benefici significativi per le persone colpite da tale affezione”. Per beneficio significativo si intende “un miglioramento sostanziale delle condizioni del paziente dal punto di vista clinico o dal punto di vista della cura generale”. Il richiedente deve dimostrare tale beneficio nei confronti di un medicinale o un metodo autorizzato esistente al momento dell'assegnazione. Dato che l'esperienza clinica potrebbe essere poca o nulla col medicinale orfano in questione, la motivazione di beneficio significativo potrebbe essere fatta dal richiedente sulla base di presupposti di beneficio. In ogni caso il COMP deve valutare in che misura tali presupposti siano attestati da dati/prove forniti dal richiedente.
Politica nazionale: uno sguardo all’Italia
In Italia, dove si stima che le persone affette da malattie rare siano circa 5 milioni, non esisteva alcuna normativa prima dell’introduzione del Piano Sanitario Nazionale 1998- 2000 grazie al quale sono stati individuati alcuni interventi prioritari da realizzare.
Nel maggio 2000 Farmindustria ha siglato con UNIAMO (la Federazione Italiana delle malattie rare) un protocollo d’intesa per sollecitare politici e istituzioni a sviluppare la ricerca sui farmaci orfani. Ciò che le industrie chiedono, per poter collaborare alla lotta contro le malattie rare e sostenere investimenti ad alto rischio in questo settore, sono misure come le agevolazioni fiscali, la costituzione di un fondo speciale per il finanziamento di queste ricerche, il recepimento della direttiva europea sui brevetti biotecnologici.
Il piano sanitario nazionale italiano stabilisce, fino a questo momento, solo metodi generici per migliorare la disponibilità dei medicinali. Il progetto di regolamento sulla rete nazionale per le malattie rare e l’esenzione dai contributi alle spese, che si stanno varando in questi anni, non contemplano iniziative particolari: continueranno ad applicarsi le norme vigenti in tema di fornitura di medicinali ai pazienti. È tuttavia ragionevole presumere che verranno presi provvedimenti adeguati per garantire una più ampia disponibilità di medicinali nell’ambito del sistema sanitario nazionale.
Il primo bando di concorso per la ricerca indipendente, promosso dall’Agenzia Italiana del Farmaco (AIFA) per l’anno 2005 viene reso possibile dall’istituzione di un fondo alimentato dal contributo pari al 5% delle spese promozionali effettuate dalle aziende farmaceutiche. Si è trattato di un’iniziativa innovativa che, seppure limitata rispetto al complesso degli investimenti nel campo della ricerca biomedica, rappresenta un investimento di rilievo.
La caratteristica del bando è rappresentata dal voler promuovere una ricerca clinica di rilevante interesse per il Servizio Sanitario Nazionale (SSN).
Coerentemente con tale indirizzo programmatico una delle tre grandi aree individuate come di interesse prioritario è quella delle malattie rare, che risponde soprattutto alla carenza di interesse di mercato. In particolare i Progetti ammessi al finanziamento per l’anno 2005 per i farmaci orfani e negletti sono stati suddivisi in due gruppi:
- ricerche cliniche su farmaci orfani disponibili da parte del SSN per migliorarne le conoscenze di efficacia e sicurezza;
- ricerche cliniche su farmaci orfani non ancora approvati e commercializzati per migliorarne le conoscenze di efficacia e sicurezza.
Per quanto concerne il fondo per le malattie rare e la ricerca indipendente (Fonte: Comunicato AIFA n.12 del 19 maggio 2005):
- il 50% viene destinato al Fondo nazionale per l’impiego di farmaci orfani per le malattie rare in attesa di commercializzazione;
- il restante 50% viene destinato alla promozione della ricerca indipendente ed altre attività dell’AIFA (programmi di farmacovigilanza, istituzione di un centro di informazione indipendente sul farmaco, programmi di comunicazione per un uso appropriato dei farmaci ed attività di formazione).
Un panel di esperti, tra cui la direttrice di Orphanet France, centro francese di coordinamento dei dati europei sulle malattie rare e i farmaci orfani, chiamato per valutare i progetti di ricerca finanziati dall’AIFA, è rimasto ben impressionato da questa iniziativa italiana che, nel suo genere, può essere definita unica in Europa.
Si ritiene che questa prima esperienza debba servire anche a capire quali aspetti del processo dovranno essere ottimizzati in futuro.
La rete delle malattie rare nel Piano Sanitario 2006-2008
Lo sforzo già compiuto nel triennio 2003-2005 per la tutela dei soggetti affetti da malattie rare dovrà essere intensificato. Se è vero, infatti, che le Regioni hanno formalmente individuato i presidi deputati alla diagnosi delle malattie ed alla presa in carico dei pazienti, è anche vero che la costituzione della Rete è ancora agli inizi e la collaborazione tra i presidi deve essere fortemente implementata.
E’ necessario che si attuino azioni atte a garantire ai pazienti con malattie rare un’assistenza omogenea su tutto il territorio nazionale.
Per molte delle malattie rare comprese nell’elenco allegato al decreto ministeriale 18 maggio 2001 n. 279 è ragionevole ritenere che in ogni Regione possa essere garantito un approccio adeguato, funzionale ad evitare gravosi spostamenti di pazienti. E’ pur vero che per malattie estremamente rare, così come per quelle che richiedono trattamenti particolarmente impegnativi, si dovrà giungere all’identificazione di presidi di riferimento sovraregionali o nazionali, che opportunamente supportati, possano garantire assistenza superspecialistica per il periodo necessario e che si raccordino con i centri vicini al domicilio dei pazienti per quanto riguarda il monitoraggio più a lungo termine.
Il potenziamento della Rete per le malattie rare dovrà infine tendere non solo a garantire l’assistenza ai pazienti al meglio delle attuali potenzialità, ma anche a sviluppare azioni che contribuiscano a migliorare le possibilità di cura oggi inadeguate per la maggior parte di queste patologie. Le principali azioni da sviluppare nel triennio sono le seguenti (Fonte: Un “New deal della Salute” - Programma del Governo del Ministro Livia Turco - ministerosalute.it):
- sviluppare i rapporti tra i presidi della Rete per diffondere e consolidare protocolli diagnostici e terapeutici per le malattie rare;
- promuovere l’integrazione delle competenze per garantire sia un approccio multidisciplinare a condizione complesse che maggiori possibilità di successo nella ricerca;
- diffondere nella popolazione le informazioni sui presidi della Rete, anche attraverso le associazioni dei malati e dei loro familiari, per garantire una diagnosi ed una presa in carico tempestiva ed evitare gli accessi ripetuti presso strutture sanitarie prive della necessaria esperienza specifica;
- aggiornare l’elenco delle malattie rare allegato al decreto ministeriale n. 279/2001, sulla base delle più recenti acquisizioni scientifiche nel settore;
- consolidare l’attività del Registro nazionale delle malattie rare istituito presso l’Istituto Superiore di Sanità, sviluppando ed omogeneizzando l’attività dei registri regionali;
- sviluppare programmi di ricerca sulla diagnosi ed il trattamento delle malattie rare e favorire la disponibilità dei farmaci orfani;
- promuovere la formazione e l’aggiornamento degli operatori.
Politica sui farmaci orfani in Giappone
Il programma di sviluppo dei farmaci orfani in Giappone è stato intrapreso nel 1985 dal Ministero del Lavoro e della Salute (Ministry of Health Labour and Welfare, MHLW) con l'introduzione di una domanda di ammissione per nuovi farmaci semplificata (Japanese New Drug Application, J-NDA) nell'ambito dei farmaci orfani.
Ulteriori misure a supporto dello sviluppo di tali farmaci sono entrate in vigore nel 1993 con l'aggiornamento del programma esistente sulla base dell'Orphan Drug Act emanato dall'FDA negli Stati Uniti, che ha introdotto specifiche clausole relative alla ricerca e allo sviluppo dei farmaci orfani. Secondo queste nuove disposizioni, la qualifica di “orfano” può essere accordata ad un farmaco se questo risponde pienamente ai due criteri seguenti:
- la malattia per la quale è rivendicato l’uso del farmaco deve essere incurabile; non devono esistere cure alternative, o meglio l’efficacia e la sicurezza attesa del prodotto devono risultare migliori in confronto agli altri farmaci disponibili;
- il numero di pazienti affetti da questa malattia sul territorio giapponese deve essere inferiore a 50.000, che corrisponde ad una prevalenza della malattia di 4/10.000.
Qualifica di farmaco orfano e status legale
La designazione di farmaco orfano è accordata dall' MHLW. Il sotto comitato dei
farmaci orfani è incaricato della valutazione scientifica e le conclusioni sono inviate ad
un comitato speciale. Per ottenere la designazione di farmaco orfano, gli sponsor
devono fornire i seguenti dati alle autorità:
- stima del numero dei pazienti nella popolazione;
- studi non-clinici e di fase precoce;
- protocollo di sviluppo del farmaco e razionale scientifico a supporto della necessità del farmaco in Giappone.
Una volta concessa la qualifica di farmaco orfano, questa può essere ritirata qualora le condizioni della licenza non siano più rispettate.
Incentivi per i produttori di farmaci orfani in termini di proprietà intellettuale
e commercializzazione
 Il sostegno alla ricerca e allo sviluppo dei farmaci orfani da parte del governo
giapponese si esplica a livello amministrativo e finanziario. A livello amministrativo i farmaci orfani beneficiano di una procedura di commercializzazione accelerata (Fast-
Track Marketing Authorization Procedure) che riconosce come prioritarie le richieste
presentate per le terapie relative alle malattie rare. Inoltre, l' Organizzazione per la
Sicurezza e la Ricerca Farmaceutica (Organization for Pharmaceutical Safety and
Research, OPSR) offre alla industrie farmaceutiche che sponsorizzano farmaci orfani
una consulenza sui protocolli di sviluppo e la documentazione necessaria per la richiesta
di designazione di farmaco orfano.
Il sostegno alla ricerca e allo sviluppo dei farmaci orfani da parte del governo
giapponese si esplica a livello amministrativo e finanziario. A livello amministrativo i farmaci orfani beneficiano di una procedura di commercializzazione accelerata (Fast-
Track Marketing Authorization Procedure) che riconosce come prioritarie le richieste
presentate per le terapie relative alle malattie rare. Inoltre, l' Organizzazione per la
Sicurezza e la Ricerca Farmaceutica (Organization for Pharmaceutical Safety and
Research, OPSR) offre alla industrie farmaceutiche che sponsorizzano farmaci orfani
una consulenza sui protocolli di sviluppo e la documentazione necessaria per la richiesta
di designazione di farmaco orfano. La durata della validità della registrazione che determina un regime di esclusività sul mercato varia da 4 a 6 anni per i farmaci tradizionali. Per i prodotti orfani tale periodo è stato esteso a 10 anni. A livello finanziario sono disponibili alcuni finanziamenti governativi come il Drug Fund for Side-Effects Relief and Research Promotion, fondo speciale che garantisce l’assistenza finanziaria per coprire una parte delle spese dedicate alla ricerca e allo sviluppo dei farmaci orfani.
I finanziamenti coprono anche le attività scientifiche e la diffusione di consulenze in termini di sviluppo, riguardante, specificatamente, le sperimentazioni cliniche.
Le autorità giapponesi rimborsano fino al 50% dei costi di sviluppo; inoltre sono garantiti sgravi fiscali fino al 6% per le spese di Ricerca e Sviluppo, e fino al 10% per le tasse. Nel caso in cui le industrie realizzino profitti sulle vendite di prodotti orfani sono tenute al versamento di una percentuale del sovvenzionamento che hanno ottenuto come contributo per fondi speciali.
torna al menù
I medicinali orfani e il loro mercato
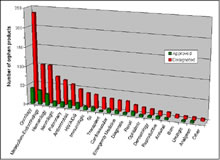 Dal momento in cui l’Orphan Drug Act (ODA) è stato approvato negli Stati Uniti ad
oggi, 1732 farmaci hanno ottenuto la designazione di medicinale orfano.
Dal momento in cui l’Orphan Drug Act (ODA) è stato approvato negli Stati Uniti ad
oggi, 1732 farmaci hanno ottenuto la designazione di medicinale orfano. Di questi, 305 prodotti risultano approvati per la commercializzazione e 3 prodotti hanno ricevuto l’autorizzazione dall’inizio dell’anno (www.fda.gov; dati aggiornati al 10/07/2007).
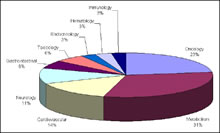
La maggior parte dei medicinali ha ricevuto la designazione per il trattamento di rare forme di cancro (31%).
I farmaci per la cura di disordini metabolici rappresentano il secondo gruppo per importanza (11%). Circa il 50% di prodotti orfani che hanno ottenuto l’approvazione sono per uso pediatrico (Haffner, 2003).
La legislazione europea in fatto di farmaci orfani è molto più recente rispetto a quella statunitense. Questo si riflette sul numero di prodotti che hanno ricevuto la designazione di farmaco orfano e sui prodotti in possesso di autorizzazione alla commercializzazione.
Analizzando i dati aggiornati disponibili sul sito ufficiale dell’Unione Europea (ec.europa.eu), risulta che la designazione di prodotto orfano è stata concessa in quasi 400 casi (il numero scende a 350 se si tiene conto di un’unica indicazione terapeutica per prodotto).
I farmaci orfani autorizzati al commercio sono 35, di cui 4 hanno ricevuto l’autorizzazione nell’anno in corso.
Il 31% di questi farmaci è stato autorizzato per il trattamento di disfunzioni metaboliche ed il 23% per il trattamento di forme tumorali (Orphanet Reports Series; www.orpha.net).
 L’approvazione di una legislazione specifica per regolamentare questo settore ha creato
nuove opportunità di mercato. Di conseguenza prima negli Stati Uniti, e poi nei vari
paesi che hanno legiferato in proposito, si è assistito alla nascita di molte nuove aziende
di piccole e medie dimensioni il cui primo prodotto (e spesso anche i successivi) era
destinato al mercato dei farmaci orfani.
L’approvazione di una legislazione specifica per regolamentare questo settore ha creato
nuove opportunità di mercato. Di conseguenza prima negli Stati Uniti, e poi nei vari
paesi che hanno legiferato in proposito, si è assistito alla nascita di molte nuove aziende
di piccole e medie dimensioni il cui primo prodotto (e spesso anche i successivi) era
destinato al mercato dei farmaci orfani.Nel caso statunitense, obiettivo dell’ODA e dei successivi emendamenti è stato quello di incoraggiare la ricerca, lo sviluppo e la commercializzazione dei farmaci orfani per il trattamento delle malattie rare attraverso specifici incentivi:
- credito d’imposta;
- finanziamenti alla R&S di farmaci orfani;
- esclusiva di mercato;
- esenzione dal pagamento dei diritti relativi alla domanda di approvazione della FDA;
- assistenza per l’elaborazione di protocolli;
- accesso a finanziamenti per lo svolgimento dei trials clinici.
La legislazione approvata nell’Unione Europea ha cercato di seguire da vicino quella statunitense. Anche in questo caso sono stati predisposti una serie di incentivi per promuovere la ricerca nel campo dei medicinali orfani:
- esclusiva di mercato;
- assistenza per l’elaborazione di protocolli;
- accesso alla procedura centralizzata europea;
- inoltre l’art. 9 del Regolamento N. 141/2000 prevede che i medicinali qualificati orfani possano beneficiare di incentivi messi a disposizione dalla Comunità e dagli Stati Membri allo scopo di promuovere la ricerca, lo sviluppo e l’immissione in commercio dei medicinali orfani, incentivi rivolti in particolare alle piccole e medie imprese.
Una serie di fattori, indipendenti da quelli direttamente legati alla legislazione, ha reso attrattivo questo campo di ricerca:
- la dimensione limitata dei pazienti a disposizione rende la loro gestione più semplice ad una start-up;
- la maggiore facilità nella gestione di uno studio clinico (anche se lo scarso numero di pazienti a disposizione è allo stesso tempo un limite per la buona riuscita dello studio);
- la distribuzione del prodotto approvato è più semplice;
- le reazione avverse al prodotto riportate sono poche (in numero).
Va anche considerato che l’immissione sul mercato di un farmaco orfano può fornire un trampolino di lancio per l’azienda. Questo per vari motivi:
- fornisce un accesso privilegiato verso la classe medica;
- fornisce un accesso privilegiato a collaborazioni scientifiche;
- risulta particolarmente attrattivo per gli stakeholders.
Negli anni si sono quindi venute a creare delle aziende specializzate nella ricerca e sviluppo di farmaci orfani. Sul mercato americano si sono distinte le seguenti (dati relativi al 2006; http://www.fda.gov/orphan/designat/list.xls):
- Amgen, Inc. (fatturato mondiale 2006 pari a 14,2 miliardi di dollari) - 19 designazioni, 6 medicinali orfani approvati;
- Allergan, Inc. (fatturato mondiale 2006 pari a 3 miliardi di dollari) - 10 designazioni, 4 medicinali orfani approvati;
- Genentech (fatturato in US pari a 7,2 miliardi di dollari) - 22 designazioni, 8 medicinali orfani approvati;
- Genzyme (fatturato mondiale 2006 pari a 3,2 miliardi di dollari) - 24 designazioni, 7 medicinali orfani approvati.
Allo stesso modo anche compagnie farmaceutiche di stampo classico hanno dimostrato il loro interesse per questo settore:
- Bristol-Myers Squibb - 17 designazioni, 8 medicinali orfani approvati;
- Eli Lilly - 7 designazioni, 3 medicinali orfani approvati;
- Hoffman-LaRoche, Inc. - 24 designazioni, 7 medicinali orfani approvati;
- Novartis - 23 designazioni, 10 medicinali orfani approvati.
Ma tali farmaci, possono veramente rendere un profitto all’azienda? Per prima cosa bisognerebbe stabilire univocamente quanto costi ad un’azienda introdurre un nuovo medicinale sul mercato. Su questo punto le voci sono discordanti.
Uno studio del 2003 sostiene che la cifra sia compresa fra 402 e 793 milioni di dollari (DiMasi et al.), mentre altri quantificano tale sforzo in 115-240 milioni di dollari (Global Alliance for TB drug development, 2001; Crompton, 2002).
Partendo da questo presupposto, potrebbe essere difficile indicare un livello minimo di redditività prevedibile che giustifichi e stimoli lo sforzo economico necessario per sviluppare un nuovo farmaco in generale ed un farmaco orfano in particolare. Tale livello minimo, lo si può indicativamente quantificare in 1 miliardo di dollari all’anno (Prof. Xxxxxx, comunicazione personale; Anand, 2005).
Le grandi industrie farmaceutiche difficilmente impegnano risorse per sviluppare farmaci che non permettano fatturati almeno pari a tale valore. Al contrario le piccole e medie aziende o le aziende start-up, soprattutto quelle specializzate in biotecnologie, possono essere interessate a questo genere di mercato.
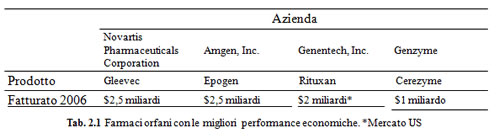 A livello mondiale, alcuni farmaci orfani forniscono un ritorno economico alle aziende
produttrici paragonabile a quello di un farmaco “convenzionale”.
A livello mondiale, alcuni farmaci orfani forniscono un ritorno economico alle aziende
produttrici paragonabile a quello di un farmaco “convenzionale”. Gli esempi più rappresentativi sono evidenziati nella tabella successiva.
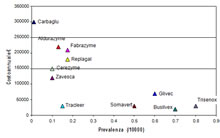 Tale elevata reddività, pur in presenza di una limitata domanda, è dovuta al regime di
monopolio in cui si trovano ad operare molte aziende che hanno sviluppato un farmaco
per il trattamento di una patologia orfana.
Tale elevata reddività, pur in presenza di una limitata domanda, è dovuta al regime di
monopolio in cui si trovano ad operare molte aziende che hanno sviluppato un farmaco
per il trattamento di una patologia orfana. Il periodo di esclusività fa in modo che per determinate patologie non esistano alternative di cura. In questi casi i prezzi dei trattamenti sono a totale discrezione delle aziende produttrici degli stessi.
Ne consegue che più è rara una certa patologia, maggiore è il costo per paziente del trattamento (Alcimed, 2005)), come riportato in figura.
torna al menù
Farmaci Orfani: questioni etiche
Valutazioni economiche nell'ambito dei farmaci orfani
La decisione di quanto una società debba spendere nella ricerca sulle malattie rare, e sui farmaci destinati a curarle, rappresenta un dilemma morale. Da una parte, ogni patologia rara rappresenta solo un piccolo numero di individui che rappresentano entro termini legali e politici una particolare società.L’investimento di una sostanziale quantità di risorse per le patologie rare potrebbe quindi essere considerata non etica da un punto di vista utilitaristico, poiché non vengono massimizzati i benefici per la collettività. D’altra parte, molti sostengono che la società abbia, come obbligo morale, quello di non abbandonare gli individui che sono affetti da una malattia grave ma rara per la quale non esistono cure.
Tutti questi obblighi morali, a cui si aggiunge quello professionale della medicina di progredire nella conoscenza scientifica alla ricerca di nuove terapie, risultano tra loro contrastanti e definiscono così livelli diversi in termini di finanziamenti per la ricerca e lo sviluppo di farmaci orfani (Gericke et al., 2005). Tuttavia, è attraverso un approccio di tipo utilitaristico che ad oggi sono gettate le basi nell’ambito delle valutazioni economiche, che sempre più spesso sono usate per la definizione di decisioni prioritarie in politica sanitaria.
L’approccio più comune è basato sulla massimizzazione dei benefici sanitari in termini di un singolo indice, che tenga in considerazione l’aumentata aspettativa di vita e, contemporaneamente, la qualità della vita (Quality Adjusted Life Years, QALY o Disability Adjusted Life Years, DALY). Nessun farmaco orfano risulterebbe valido in termini di costo-efficacia con l'applicazione di tali tecniche di valutazione a causa
- della rarità delle patologie per le quali sono prodotti (i costi di sviluppo devono essere recuperati dalla vendita ad un numero limitato di pazienti);
- della scarsità di dati disponibili dagli studi clinici.
La massimizzazione dei suddetti indici potrà essere raggiunta solo nel momento in cui i pazienti con malattie rare potranno accedere a terapie approvate, per le quali saranno previsti rimborsi puntuali, condizioni che, attualmente, non rientrano negli obiettivi di alcuna politica a favore dei farmaci orfani, poiché le decisioni in merito all’accesso alla terapia e al rimborso sono di carattere nazionale, statale, e regionale (Drummond et al., 2007).
Diversi studi hanno infatti evidenziato l'esistenza di variabili ed impedimenti che condizionano l’accesso ai trattamenti disponibili per le malattie orfane.
Solo in 9 su 25 paesi dell’Unione Europea presi in esame sono presenti tutti i 10 farmaci orfani approvati e commercializzati, e solamente in 1 paese su 25 tutti i 10 farmaci sono presenti sulla lista di rimborso a carattere nazionale. Diversi sono i fattori che influenzano l’accesso alla terapia, inclusi la natura del budget (locale o nazionale, ospedaliero o non ospedaliero), il rimborso, l'allestimento (presso centri ospedalieri o meno, presso centri ospedalieri referenti o meno) ed il valore della terapia secondo un'analisi di costo-efficacia (Alcimed, 2005). In questi termini, la valutazione in materia sanitaria e tecnologica si basa sulla comparazione del rapporto ICER (Incremental Cost Effectiveness Ratio) con il valore che esprime la disponibilità di una società a pagare per una nuova tecnologia (Willingness-to-pay).
Tale rapporto considera l'analisi costo- efficacia della nuova terapia rispetto all'analisi costo-efficacia dei trattamenti già disponibili per la patologia in questione. Poiché nel 40% delle malattie per cui sono stati approvati farmaci orfani nell'Unione Europea non sono presenti trattamenti alternativi accettabili (COMP, 2005), ci si chiede quanto con queste tecniche di valutazione si rappresentino le preferenze della società, dal momento che un simile approccio prevede la comparazione dell'incremento di costo-efficacia di un nuovo farmaco, per il quale è disponibile uno standard di cura, contro quello per un farmaco nuovo per cui tale cura, attualmente, non esiste.
Come messo in luce da un recente studio (Drummond et al., 2007) esiste una deviazione tra il valore di costo-efficacia ed il valore espresso dalla società come illustrato dalla figura.
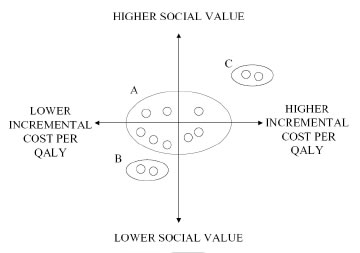 Per molte tecnologie utili in sanità la severa applicazione dei criteri di efficienza può
essere una buona approssimazione del valore sociale (Gruppo A).
Per molte tecnologie utili in sanità la severa applicazione dei criteri di efficienza può
essere una buona approssimazione del valore sociale (Gruppo A). Tuttavia ci sono interventi con rapporti di costo-efficacia inferiori che non rientrano tra quelli pubblicamente rimborsabili (Gruppo B). D'altro canto si possono presentare casi, tra cui si annoverano i farmaci orfani, di interventi con un ICER molto più alto del valore soglia, che vengono finanziati in virtù di un alto valore sociale (Gruppo C).
In questo dibattito diventa quindi critico il problema della distribuzione delle risorse, che può essere considerato da due distinti punti di vista, quello dell'efficienza tecnica e quello dell'efficienza allocativa.
Con questi termini s'intendono, rispettivamente, il modo con cui vengono messe a disposizione, ad ogni costo, le terapie risultanti dai progressi della medicina e il modo con cui le risorse vengono distribuite.
In assenza di trattamenti alternativi (o di comparabile efficacia) l'uso dell'analisi costo-efficacia come strumento per rivelare le preferenze sociali è giustificato da una prospettiva di efficienza tecnica, mentre non è sufficiente dal punto di vita della distribuzione delle risorse, risultando incompatibile con i principi di equità e solidarietà che contraddistinguono il modo di fare politica sanitaria soprattutto a livello Europeo.
Farmaci orfani: investimenti legittimi?
Da un punto di vista solidale è quindi facile giustificare gli investimenti in ricerca e sviluppo di farmaci orfani, ma i crescenti tagli nella spesa farmaceutica e la disponibilità di budget sempre più limitati pongono l'accento sulla legittimità di tali sovvenzionamenti poiché, in base al principio economico di costo-opportunità, un finanziamento speciale per i farmaci orfani sottrae risorse ad altre patologie croniche che affliggono un numero maggiore di pazienti (McCabe et al., 2005).Secondo alcuni Autori, tralasciando la definizione, i farmaci orfani non sembrano essere poi tanto orfani, come evidenzia il crescente interesse delle industrie farmaceutiche verso questi prodotti. Le domande di assegnazione della denominazione di "Orphan Drug" che l'EMEA ha valutato sono passate da 72 nel 2000 a 430 nel 2004, di cui rispettivamente 26 e 262 si sono concluse con un parere positivo. Tra i molti fattori associati al successo commerciale dei farmaci orfani si ipotizzano i seguenti:
- prezzo di vendita, spesso elevato vista l'innovatività riconosciuta a tali principi attivi;
- il crescente rilascio di AIC a farmaci orfani in un numero sempre crescente di paesi;
- la possibilità di individuare stadi o manifestazioni di una malattia come entità distinte per le quali richiedere la designazione di farmaco orfano. In altre parole, le medie e grandi aziende farmaceutiche avrebbero interesse a segmentare gli usi terapeutici di un farmaco in sotto-segmenti in modo da ottenere la designazione di farmaco orfano ed, in tal modo, accelerare l’accesso al mercato.
Infine, in alcuni Paesi, quali la Germania, la Spagna, la Francia, l’Olanda, la Svezia e l’Italia, un farmaco orfano inserito in una lista di rimborsabilità nazionale è automaticamente rimborsato, spesso in modo totale, dal servizio sanitario nazionale di quel Paese. Anche nei paesi nei quali è prevista la compartecipazione del paziente all’acquisto di un farmaco, come in Francia, Spagna e Germania, il costo del farmaco orfano sistematicamente eccede il limite stabilito per la compartecipazione stessa.
Inoltre, nei paesi ove è vigente un sistema di prezzi di riferimento, come la Germania, il farmaco orfano non può essere incluso nel confronto, perché spesso rappresenta l’unica alternativa terapeutica disponibile ed è, pertanto, automaticamente posto a totale carico della sanità pubblica.
A questo aspetto si aggiunge a volte il fatto che la validità dei dati di efficacia e sicurezza clinica di questi prodotti, all’atto dell’immissione in commercio, può non essere soddisfacente e sufficiente. Pertanto, i servizi sanitari nazionali possono trovarsi nella situazione di “pagare per un bene il cui profilo rischio-beneficio è presunto, ma non ancora dimostrato”, come riportato in un autorevole editoriale (Berto, 2006).
torna al menù
Farmaci Orfani: una classificazione più ampia
 Una classificazione più ampia dei farmaci orfani comprende indicazioni non
necessariamente correlate alle malattie rare.
Una classificazione più ampia dei farmaci orfani comprende indicazioni non
necessariamente correlate alle malattie rare.Ci si può infatti riferire anche a “condizioni orfane”, nel caso in cui le caratteristiche del mercato legato a certi prodotti non siano, per diverse ragioni, così redditizie da suscitare l’interesse delle aziemde farmaceutiche.
E’ il caso dei prodotti non sviluppati, la cui condizione può essere determinata dal fatto che siano frutto di un processo di ricerca non brevettabile, o dal fatto che non possano essere acquistati per mancanza di fondi, ad esempio come per i farmaci destinati alla cura delle malattie tropicali, particolarmente diffuse nel terzo mondo.
I numeri coinvolti in questo tipo di patologie sono ben distanti dalla “rarità” a cui si è finora fatto riferimento considerando i farmaci orfani, e contrariamente a quanto intuitivo pensare, il concetto di “orfano” mette in relazione popolazioni di pazienti molto diverse fra loro, sollevando, di nuovo, problematiche legate alla distribuzione delle risorse.
Nella stessa classificazione rientrano inoltre tutta una serie di farmaci che risultano orfani perché ritirati dal mercato per ragioni economiche o farmacologiche, come nel caso della talidomide.
Nei capitoli seguenti vengono riportati alcuni esempi di farmaci orfani relativi a tutte e tre queste definizioni, con l’intento di presentare le molteplici problematiche che contraddistinguono le diverse parti in causa presenti nel mercato legato ai farmaci orfani.
torna al menù
Farmaci Orfani destinati alla cura di malattie rare
I casi legati alle seguenti patologie sono riportati soprattutto a titolo di esempio dell’eterogeneità di fronte alla quale ci si trova considerando le malattie rare.Deficienza di N-acetilglutammato sintasi (NAGS)
La deficienza di N-acetilglutammato sintasi (NAGS) è una malattia metabolica. Le malattie metaboliche sono disordini rari ed ereditari che risultano da deficienze qualitative o quantitative degli enzimi responsabili delle singole reazioni dei processi metabolici.L'enzima NAGS, insieme ad altre cinque attività enzimatiche, è coinvolto nel ciclo di Krebs-Henseleit, processo metabolico responsabile della detossificazione dell'ammonio, sostanza tossica, in urea, sostanza eliminabile attraverso l'urina.
La deficienza in uno di tali enzimi (disturbo a carico del ciclo dell'urea) si traduce nell'accumulo di ammonio nel sangue, in un processo che a seconda della gravità della malattia può variare da diverse ore a diversi giorni, ma che generalmente comporta lo sviluppo di encefalopatia entro 72 ore dalla nascita che risulta fatale se non prontamente curata. L'incidenza con cui si manifestano i disturbi a carico del ciclo dell'urea è di 1/30000 nati, anche se questo dato è probabilmente sottostimato a causa dell'elevato numero di decessi di pazienti affetti da questi disturbi prima che venga stabilita una diagnosi. Diviene quindi indispensabile la capacità di riconoscere tali disturbi in modo tempestivo.
Tra le patologie a carico del ciclo dell'urea la deficienza di NAGS è la meno frequente; il primo caso diagnosticato fu pubblicato nel 1981 e da allora sono stati identificati 42 pazienti in tutto il mondo (dati messi a disposizione da Orphan Europe).
Un farmaco per la cura di questa malattia è prodotto dalla Orphan Europe, azienda fondata nel 1990 che si occupa dello sviluppo e della distribuzione di farmaci orfani per la cura di malattie rare, nella convinzione che
“…ogni singolo paziente abbia diritto alla miglior terapia possibile…”.
Carbaglu è il nome commerciale di tale farmaco, utile nel trattamento dell'iperammoniemia dovuta a deficienza di N-acetilglutammato sintasi.
Il principio attivo è costituito da acido carglumico, analogo strutturale dell' N-acetilglutammato, un attivatore naturale del ciclo dell'urea, e dal momento in cui è stato reso disponibile è stato somministrato a 20 pazienti a livello globale, 12 dei quali affetti da deficienza di NAGS e i rimanenti 8 affetti da altri disturbi a carico del ciclo dell'urea.
In termini di sopravvivenza i risultati dati dall'individuazione dell'acido carglumico come terapia di sostituzione hanno dato i risultati seguenti:
- senza alcun trattamento 0%;
- con terapia convenzionale 31%;
- con acido carglumico 95%.
Si sottolinea inoltre che nel 52% dei casi trattati con terapia convenzionale sono presenti scompensi clinici che richiedono ospedalizzazione, che risultano disabilitanti o fatali nel 38% dei casi, a differenza della terapia con acido carglumico per la quale non si sono registrate crisi (dati messi a disposizione da Orphan Europe).
In uno scenario simile è facile comprendere i problemi relativi alla distribuzione del farmaco nelle strutture ospedaliere e al mantenimento di una rete organizzata di contatti alla quale afferire in caso di emergenza. Positivo in tal senso è stata l'esperienza riportata dalla Orphan Europe che si impegna a monitorare il consumo del farmaco presso i centri nei quali sono in cura i singoli pazienti, sollecitando la struttura ospedaliera all'approvigionamento delle scorte necessarie. Con l'intento inoltre di agevolare l'acquisto del farmaco a livello ospedaliero, l'azienda si propone di intervenire sulla dimensione delle confezioni, che sono rese più piccole per renderle più economiche e limitare gli sprechi di farmaco.
In un'intervista con il direttore generale della sede italiana di questa azienda (Dr. X. Xxxxxxxx) sono emerse una serie di problematiche legate al commercio dei farmaci orfani.
La scelta di questo settore identifica il tentativo di garantire un accesso equo alla migliore terapia anche per i pazienti che soffrono di malattie rare, il che comporta la condivisione, da parte di tutti i dipendenti dell'azienda, di una cultura basata sulla solidarietà e sulla responsabilità sociale.
Questo facilità la gestione di criticità intrinseche in questo settore quali, ad esempio, la reperibilità al di fuori dell'orario di lavoro del personale, che deve essere in grado di fornire indicazioni in merito ai centri presso i quali il farmaco è disponibile.
I farmaci orfani poi, pur essendo incentivati da una normativa specifica, non godono di un regime di protezione contro i tagli della spesa economica, che, non potendo ripercuotersi sul già scarso margine ricavato dalla vendita dei farmaci orfani, ricade su tutte le divisioni aziendali.
Per questo motivo vengono ridotte al minimo le azioni di marketing, che si concentrano sui tipi di medico coinvolti nella diagnosi della malattia rara, nel caso della deficienza di NAGS, metabolici e neonatologi. E' soprattutto su questi ultimi, che si interviene per diffondere la conoscenza della malattia in modo da rendere più semplice l'interfacciarsi di questi specialisti con gli esperti di metabolismo, in grado di prescrivere il farmaco. Anche il packaging e il materiale informativo sono soggetti a limitazioni nel budget, che si traducono nell'utilizzo di un'unica confezione sulla quale sono riportate le indicazioni in più di una lingua, e nella stesura di brochure informative solo in inglese.
Malattia di Gaucher e possibilità di cura
La Malattia di Gaucher è un disordine metabolico ereditario molto raro causato dalla carenza dell’enzima glucocerebrosidasi. Questo enzima è contenuto nei lisosomi dei macrofagi ed ha il compito di idrolizzare il glicogeno, o glucocerebroside, in glucosio (zuccheri) e ceramide (grassi).Come risultato di questa carenza, il glucocerebroside si accumula nei lisosomi dei macrofagi, che quindi crescono di dimensioni dando origine alle cosiddette "cellule di Gaucher".
Queste ultime si concentrano soprattutto nella milza, nel fegato e nel midollo osseo, alterando le normali funzioni di questi organi. La malattia di Gaucher è diffusa in tutte le etnie e viene ereditata con meccanismo di tipo autosomico recessivo (occorre cioè che entrambi i genitori portatori trasmettano al figlio il gene alterato.
Tale malattia è stata classificata in tre tipi:
- Tipo 1 (incidenza pari a 1 su 40.000-60.000) con decorso cronico non neurologico colpisce bambini ed adulti ed è la forma più comune di malattia;
- Tipo 2 (incidenza pari a meno di 1 su 100000) è la forma più grave della malattia con prognosi infausta per lo più verso i 2-3 anni di vita;
- Tipo 3 (incidenza pari a 1 su 50.000-100.000) con decorso variabile caratterizzato da un lento e progressivo interessamento neurologico.
La prima industria farmaceutica che ha investito le proprie risorse per dare una possibile terapia per la malattia di Gaucher è stata la Genzyme che, nel 1994, ha proposto una terapia enzimatica sostitutiva (Enzyme Replacement Therapy, ERT) adoperando un analogo dell'enzima glucocerebrosidasi.
Il nuovo farmaco, il Cerezyme®, compensa la carenza dell'enzima evitando l'accumulo di glucocerebroside ed è attualmente l'unica terapia disponibile.
Di fatto la Genzyme si trova ad operare in regime di monopolio. Questo si riflette sul prezzo del farmaco, decisamente elevato. D'altra parte, la Genzyme ha istituito nel 2004 l'European Cerezyme Access Programme (ECAP), per fornire nei paesi dell'Europa dell'Est e nei Paesi Balcanici, su base umanitaria (uso compassionevole) il Cerezyme ai malati più gravi o a rischio di vita.
Finora, hanno usufruito dell' ECAP 100 pazienti, di cui 47 sono bambini, 9 dei quali affetti dalla malattia di Gaucher di Tipo III (Associazione Pazienti Gaucher Onlus, Newsletter 2007).
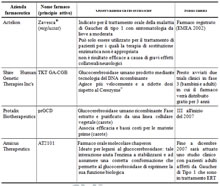
Farmaci in via di sperimentazione
Se per dieci anni non si è sentita l'esigenza di investire in una terapia di seconda generazione o biosimile, recentemente si è assistito ad un'inversione di tendenza.
Infatti, una serie di aziende farmaceutiche ha ritenuto il mercato legato alla sindrome di Gaucher particolarmente redditizio, ed ha così incentivato la ricerca e lo sviluppo di approcci terapeutici innovativi.
Accanto una rappresentazione ad oggi dello stato dell'arte.
La malattia di Gaucher dal punto di vista dei pazienti
Non si può dimenticare che un ruolo fondamentale nella diffusione dell'informazione, nella promozione dei diritti civili, nelle iniziative di assistenza sociale ed infine nell' incentivare la ricerca scientifica sulle malattie rare sia svolto dalle associazioni di pazienti e loro familiari.
Fondata nel Settembre 1997, per iniziativa di 4 associazioni francesi, la European Organisation for Rare Disorders (EURORDIS) è una federazione che raggruppa oltre 200 associazioni operanti in 14 paesi europei.
EURORDIS ha avuto un ruolo significativo nel promuovere l’adozione di un regolamento europeo per i farmaci necessari alla cura di malattie rare e si propone di incentivare lo scambio di informazioni tra gruppi di ricercatori e le indagini volte a chiarire i bisogni dei pazienti e delle loro famiglie.
Il principio base delle associazioni è l'aiuto reciproco, che si esplica favorendo l'informazione e la formazione per un miglior accesso alla diagnosi, alle cure, ai diritti e all'integrazione dei pazienti.
Il loro merito è stato quello di far rilevare come solo "apparentemente" ogni malattia rara sembra unica nei suoi "bisogni" e come, invece, tutte le malattie rare siano accomunate da stesse problematiche socio-assistenziali, mediche e terapeutiche. I pazienti solitamente ripongono molta fiducia in queste associazioni e sono convinti che esse agiscano nell’interesse del malato in maniera obiettiva ed imparziale. In realtà, a volte non è sempre così. Infatti, i rapporti tra le associazioni dei pazienti e le aziende farmaceutiche possono talvolta compromettere l’indipendenza di queste associazioni. Dal momento che le aziende farmaceutiche e le associazioni hanno diversi interessi in comune, non sorprende che queste possano entrare in conflitto. Infatti, l’interesse più importante di una società farmaceutica, legato alla capacità dell’azienda di vendere i propri prodotti, può facilmente contrastare con gli interessi primari dei malati. In Italia, operano diverse associazioni di pazienti, alcune note al pubblico e attive da molti anni, altre di più recente formazione o meno conosciute proprio perché si occupano di problemi che coinvolgono poche persone. Dal 1992 è attiva l'Associazione Italiana Gaucher Onlus (gaucheritalia.org) che anche se con notevoli sforzi cerca di portare avanti la propria battaglia.
Da un'intervista con la presidentessa (X. Xxxxxxxx) è emerso che il paziente se da una parte è fiducioso nelle autorità e nell'operato delle aziende, dall'altra ha sempre più l'esigenza di informarsi sulla propria patologia mosso da un disperato bisogno di cura.
Scopo principale della suddetta associazione è quello di tutelare il diritto del paziente affinché questo venga visto come individuo e non come semplice cavia, di supportare psicologicamente sia le famiglie che i malati affinché si consideri l'impatto della terapia sull'individuo e non solo i possibili benefici che questo ne può eventualmente trarre. Si deve appunto valutare come i diversi aspetti dello studio clinico possano essere invasivi, intrusivi e stressanti. Inoltre, devono essere prese in considerazione le aspettative, le speranze e le ansie del paziente e della famiglie per tutta la durata dei trials.
Sempre secondo le proprie possibilità l'Associazione Italiana Gaucher Onlus supporta economicamente le famiglie più bisognose attraverso l'erogazione parzialmente gratuita della terapia convenzionale nella convinzione che ogni individuo abbia diritto ad una cura efficace.
Ricerca sperimentale: una testimonianza diretta
Da alcuni anni una azienda italiana, la TransActiva Srl (transactiva.it), ha sviluppato un metodo innovativo per la produzione dell'enzima glucocerebrosidasi. Per poter avere maggiori informazioni sulle motivazioni che hanno spinto tale azienda ad investire in una malattia rara come quella di Gaucher, abbiamo interpellato l'amministratore delegato (Prof. X. Xxxxxx) e il responsabile scientifico (Prof. X. Xxxxxxxxx) della suddetta azienda.
Dall' intervista telefonica è emerso innanzitutto che è stata scelta una patologia orfana per motivi etici.
Inoltre, la malattia di Gaucher sarebbe stata una perfetta candidata perchè la terapia enzimatica sostitutiva si era già dimostrata negli anni un valido approccio terapeutico.
Infine un ulteriore obiettivo era promuovere l’utilizzo di linee vegetali come bioreattori per la produzione di farmaci.
In questo caso specifico è stata utilizzata la pianta di tabacco ingegnerizzata con un vettore di espressione contenente il gene deputato alla sintesi della proteina. Questa si accumula nei semi, viene estratta, purificata e successivamente, dopo adeguata formulazione, utilizzata per la terapia enzimatica sostitutiva (ERT). Nell'estate 2006 è stata presentata all' EMEA la richiesta per ottenere la designazione come farmaco orfano.
Pur avendo evidenziato che il farmaco prodotto con tale tecnologia potrebbe costare dieci volte in meno rispetto al diretto concorrente (Cerezyme?), la richiesta è stata rigettata in quanto non è stata dimostrata la superiorità terapeutica del farmaco prodotto "in pianta" rispetto alla terapia disponibile. Attualmente il farmaco è in fase di sperimentazione pre-clinica. Successivamente, una volta ottenuta l'autorizzazione da parte dell'AIFA, si potrà procedere alla fase clinica.
A conclusione delle fasi di sperimentazione clinica, se la molecola dovesse dimostrarsi sicura ed efficace, allora verrà inoltrata all'AIFA la richiesta di registrazione come farmaco "normale". Con questa designazione il prodotto non potrà beneficiare dell'esclusività alla commercializzazione concessa ai farmaci orfani. D’altro canto l’azienda aveva precedentemente tutelato la proprietà intellettuale della tecnologia richiedendo ed ottenendo un brevetto europeo a protezione della stessa.
Le ultime domande rivolte al Prof. Xxxxxx si sono concentrate sugli aspetti economici inerenti al progetto in questione (finanziamenti ottenuti ed investimenti previsti).
E’ emerso che il budget totale previsto per andare dall’idea al prodotto finito corrisponde all’incirca a 3 milioni di euro, di cui 0,5 milioni sono stati ottenuti sotto forma di finanziamento dal MIUR in base alla legge 297/99.
torna al menù
Prodotti non sviluppati
Le malattie dimenticate
Gli ultimi 6 anni sono stati testimoni di aumentati sforzi da parte delle Nazioni del G8 e delle Nazioni Unite per migliorare la salute dei 3 miliardi di persone che vivono con meno di 2 dollari al giorno.La maggior parte dell’attenzione si è focalizzata sull’intensificare gli sforzi per combattere le 3 malattie più devastanti: HIV/AIDS, tubercolosi, e malaria. Insieme queste “Big three” causano 5.6 milioni di morti all’anno (Hotez et al., 2006).
Imponenti partnership e iniziative deputate alle big three (Tabella 6.1), e l’aumentata attenzione globale su queste malattie (e sui rischi portati dall’influenza aviaria e da altre infezioni virali emergenti) sono culminati nel TIME Global Health Summit del novembre 2005 ribattezzato come “Woodstock of Global Health” .
Queste nuove iniziative e il “Woodstock” Global Health si sono impegnate per raccogliere fondi e aumentare la consapevolezza del pubblico sulla necessità di intraprendere una seria battaglia contro le big three.
Gravemente assenti da queste attività sono però un gruppo di malattie chiamate “malattie tropicali neglette”.
Le malattie neglette, o malattie trascurate, sono malattie che hanno un impatto devastante sulla vita sociale, economica e politica degli abitanti del Sud del Mondo.
Sono malattie tropicali caratterizzate da un’alta endemicità nelle aree rurali e urbane più povere dei paesi a basso reddito e compromettono la crescita dei bambini, il loro sviluppo intellettuale e la loro educazione, così come la produttività lavorativa e perciò sono una causa di povertà.
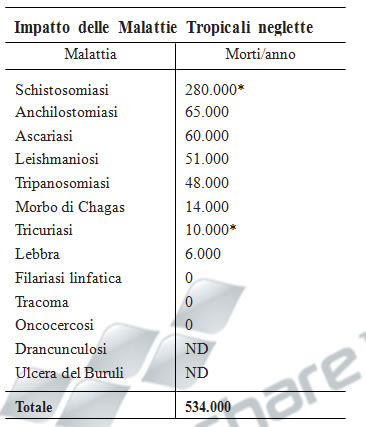 Purtroppo queste malattie rappresentano il mercato a più bassa priorità per le aziende
farmaceutiche occidentali, nonostante causino circa 534,000 morti all’anno. Anche più
significativo del tasso di mortalità sono gli anni di vita persi per la prematura disabilità.
Si stima che le malattie neglette sono seconde solo a HIV/AIDS in numero di malati,
risultando in circa 57 milioni di DALYs all’anno (disability-adjusted life years).
Purtroppo queste malattie rappresentano il mercato a più bassa priorità per le aziende
farmaceutiche occidentali, nonostante causino circa 534,000 morti all’anno. Anche più
significativo del tasso di mortalità sono gli anni di vita persi per la prematura disabilità.
Si stima che le malattie neglette sono seconde solo a HIV/AIDS in numero di malati,
risultando in circa 57 milioni di DALYs all’anno (disability-adjusted life years). Se considerate tutte insieme, le malattie tropicali neglette rappresenterebbero il 4° gruppo più importante di malattie trasmissibili in tutto il mondo, dopo infezioni respiratorie minori, HIV/AIDS e malattie diarroiche (OMS ,World Health Report 2004). L’evidenza indica che non solo queste malattie possono minacciare la salute dei poveri tanto quanto HIV/AIDS, tubercolosi o malaria, ma soprattutto che possono avere un trattamento efficace e strategie preventive in grado di essere distribuite per meno di un dollaro a testa all’anno. Inoltre gli studi epidemiologici sottolineano una sostanziale sovrapposizione geografica tra le malattie tropicali neglette e le big three, con l’emergere di nuovi dati che suggeriscono che il controllo delle neglette potrebbe diventare una potente arma per combattere HIV/AIDS, tubercolosi e malaria.
A tutt’oggi si assiste ad una carenza di trattamenti sicuri ed efficaci ma il potenziale mercato di queste malattie è insufficiente per attirare investimenti privati e pubblici per la ricerca: su un totale di 1393 farmaci sviluppati fra il 1975 ed il 1999 solo 13 (1%) sono indicati per queste malattie e spesso sono obsoleti, hanno effetti debilitanti e gravi effetti collaterali, o perdono il loro effetto a causa di insorgere di resistenza. Oltre a ciò si deve considerare che spesso sono presenti almeno 5 o 6 malattie neglette nella stessa regione a causa della non potabilità dell’acqua e della presenza di più parassiti che trasmettono queste malattie, soprattutto ai bambini (Hotez et al., 2006).
Alcuni ricercatori (Molyneux et al., 2005) hanno recentemente sviluppato una strategia per integrare programmi sia per il controllo che per l’eliminazione di 7 malattie neglette (ascariasi, tricuriasi, anchilostomiasi, filariasi linfatica, oncocercosi, schistosomiasi e tracoma) usando i farmaci esistenti.
Questi sforzi di integrazione sono particolarmente rilevanti nell' Africa Sub-Sahariana dove le malattie mostrano un alto grado di sovrapposizione geografica.
Si pensa che questo controllo integrato possa essere raggiunto con l’uso di 4 farmaci (ivermectin, albendazole, azithromycin, e praziquantel) dei quali 3 sono attualmente donati da Merck and Company, GlaxoSmithKline e Pfizer, mentre praziquantel è disponibile ad un prezzo relativamente basso. Ogni farmaco ha una specificità sovrapposta in modo che i molteplici patogeni vengano combattuti contemporaneamente da più farmaci.
Inoltre quei farmaci sono attivi anche contro infezioni da ectoparassiti (ad es. scabbia), le infezioni secondarie della pelle causate da batteri e importanti infezioni respiratorie di origine batterica.
E’ stato stimato che con 200 milioni di dollari all’anno, circa 500 milioni di Africani (0,40 dollari per paziente) potrebbero essere curati con il pacchetto integrato dei 4 farmaci (Fenwick et al., 2005; Molyneux et al., 2005). In molti paesi in via di sviluppo, inoltre, si nota una vasta sovrapposizione geografica anche tra le big three, poiché queste malattie colpiscono prevalentemente le popolazioni che sono poliparassitate. Perciò quasi tutte le maggiori malattie tropicali neglette sono collegate con le big three tramite interazioni biologiche ed epidemiologiche.
Riuscire ad integrare il controllo delle malattie neglette nei programmi di partnership globale delle big three potrebbe quindi ridurre enormemente le morti premature e le disabilità in Africa e in altri paesi del Terzo Mondo.
I benefici collaterali sono potenzialmente enormi, anche perché si unirebbero i fondi a disposizione e il controllo delle malattie neglette beneficerebbe degli sforzi per il controllo delle big three. Per troppo tempo le partnerships delle big three hanno lavorato in isolamento, così come i programmi verticali contro le singole malattie neglette.
La recente Dichiarazione di Parigi, emanata dall' High-Level Forum on the Health Millennium Development Goals (MDGs) esorta ad una maggior armonizzazione e collaborazione attraverso partnerships per la salute globale.
In futuro la coordinazione tra le partnerships di salute globale e le loro comunità di ricerca associate potrebbero dare una spinta significativa agli sforzi per ridurre malattie e povertà nel mondo.
Una nuova era
Oltre all’aumento dell’interesse nel massimizzare l’efficacia degli strumenti esistenti (come il pacchetto dei 4 farmaci) ci sono anche altre ragioni per credere che l’intervento nel controllo delle malattie neglette abbia un esito positivo (Moran, 2005), soprattutto perchè molti paesi colpiti da malattie neglette (Brasile, Egitto e India) ora possiedono le infrastrutture per condurre la propria ricerca su queste malattie, sviluppando i propri trattamenti e vaccini con solo una modesta assistenza tecnica o finanziaria da parte dei paesi più ricchi.Negli ultimi anni grazie all’impegno di varie istituzioni sia pubbliche che private sono stati raccolti miliardi di dollari per finanziare la ricerca sulle malattie neglette e sono nati nuovi progetti ed iniziative, principalmente partnership tra pubblico e privato (PPP) per lo sviluppo di nuovi farmaci per queste malattie dimenticate.
Le politiche di stimolo ed incentivo alla ricerca messe in atto da governi ed istituzioni internazionali si basavano su alcune certezze diffuse nella comunità mondiale: la mancanza di un mercato sufficientemente ampio allontanava le multinazionali del farmaco dalla ricerca e le PPP sembravano ancora un’entità troppo giovane per dimostrarsi efficace.
Su queste considerazioni i governi cercarono e cercano tuttora di stimolare l’impegno delle grandi multinazionali attraverso incentivi di mercato quali accordi sulla proprietà intellettuale o garanzie sull’acquisto di grandi quantità di farmaci.
Queste strategie di intervento non hanno però raggiunto gli obiettivi prefissati, e si è invece assistito all’aumento del numero di PPP che si occupano di sviluppo di farmaci per le malattie neglette ed al miglioramento dei risultati ottenuti da queste organizzazioni in termini qualitativi.
Un recente studio della London School of Economics (Moran, 2005) sfata la comune credenza che le industrie farmaceutiche siano disinteressate a questa categoria di malattie: infatti 6 delle più importanti multinazionali farmaceutiche partecipano a PPP per malattie tropicali, con un impegno finanziario individuale che varia dai 500.000 ai 4 milioni di dollari.
 Alla fine del 2004 i progetti di ricerca erano 63 ed hanno raggiunto quasi quota 80 nel
2006. Alcuni hanno raggiunto la fase III di sperimentazione e altri sono in fase di
registrazione. L'aumento del numero di progetti è accompagnato da cambiamenti
strutturali quali, a partire dal 2000, la nascita di nuovi istituti dedicati alla ricerca sulle
malattie dimenticate che coinvolgono più di 200 scienziati e la creazione di molte PPP
che costituiscono i ¾ dei progetti totali.
Alla fine del 2004 i progetti di ricerca erano 63 ed hanno raggiunto quasi quota 80 nel
2006. Alcuni hanno raggiunto la fase III di sperimentazione e altri sono in fase di
registrazione. L'aumento del numero di progetti è accompagnato da cambiamenti
strutturali quali, a partire dal 2000, la nascita di nuovi istituti dedicati alla ricerca sulle
malattie dimenticate che coinvolgono più di 200 scienziati e la creazione di molte PPP
che costituiscono i ¾ dei progetti totali.Questa rinnovata attività, che ha raggiunto livelli mai visti nei 20 anni passati, è cominciata per lo più in assenza di nuovi significativi incentivi e dell’intervento del settore pubblico.
L’80% dell’attività di sviluppo di farmaci da parte di PPP si fonda sulla filantropia di privati, mentre gli istituti delle industrie sono autofinanziati.
Le partnership principali sono:
- Medicines for Malaria Venture (MMV). Una delle prime PPP, nata a Ginevra nel 1999; viene finanziata principalmente da fondazioni filantropiche, agenzie governative o internazionali, ha come obiettivo la scoperta di nuovi antimalarici ed è impegnata in un totale di 23 progetti; ad ottobre 2005 erano sei i farmaci giunti alla sperimentazione clinica;
- Institute for OneWorld Health (iOWH). Compagnia farmaceutica no-profit americana, nata nel 2000, finanziata principalmente dalla Gates Foundation;
- Global Alliance for TB Drug Development (TB Alliance). Fondazione no-profit che ha come obiettivo quello di sviluppare nuovi antitubercolari, è impegnata in 10 progetti, 2 dei quali in fase clinica;
- Drugs for Neglected Diseases Initiative (DNDi). Composta da istituzioni occidentali e dei paesi più poveri. All'inizio del 2006 vi erano 20 progetti, 10 dei quali nelle prime fasi di sviluppo, 4 in fase pre-clinica e 6 in fase clinica.
Considerando questa nuova attività nel campo della ricerca farmaceutica è inevitabile chiedersi cosa la motivi e cosa renda possibile improvvisamente questa R&D “non- commerciale”.
Le multinazionali farmaceutiche conducono la metà dell’attività di ricerca e sviluppo di nuovi farmaci per le malattie neglette (32 progetti), lavorando sia con PPP che da sole (di solito con una prospettiva di una successiva collaborazione). In ogni caso queste compagnie lavorano su basi “non-commerciali” e hanno stabilito di fornire il prodotto finale a pazienti poveri nei paesi in via di sviluppo a prezzi no-profit.
Il grosso di questa attività è svolto dalle quattro industrie farmaceutiche che hanno divisioni specifiche per le malattie neglette (GlaxoSmithKline, Novartis, AstraZeneca e Sanofi–Aventis), mentre 4 altre compagnie hanno un’attività di ricerca meno formale in questo campo, conducendo uno o due progetti ciascuna.
L’altra metà dei più di 60 progetti in corso sono condotti da aziende minori che lavorano con PPP, che comprendono piccole aziende farmaceutiche, contract research organizations (C.R.O.), aziende di paesi in via di sviluppo e ricercatori accademici. La parte non accademica di questa attività si basa su basi puramente commerciali, lavorando su progetti molto più piccoli ed essendo motivati da ritorni economici molto più bassi di quelli delle grandi farmaceutiche. Le PPP ora investono nella R&D delle piccole industrie tanto quanto nei progetti di quelle più grandi.
Nei prossimi 5 anni si prevede lo sviluppo di 6/7 nuovi farmaci (Moran, 2005).
L'intervento delle PPP è risultato quindi l’elemento fondamentale che ha contribuito al coinvolgimento delle multinazionali farmaceutiche nella ricerca sulle malattie neglette.
Le multinazionali non sono motivate da obiettivi strettamente commerciali ma da considerazioni a lungo termine quali minimizzare il rischio di pressioni dell'opinione pubblica per un mancato impegno nei problemi sanitari dei paesi poveri, CSR e problematiche etiche, poter collaborare con ricercatori qualificati ed a basso costo provenienti da paesi in via di sviluppo e accedere ai mercati emergenti di questi paesi.
Inoltre la collaborazione con istituti pubblici o no-profit ha permesso la riduzione dei costi dei trials clinici, i quali possono essere eseguiti in paesi del Terzo Mondo, e la condivisione del rischio costituito dai trials stessi.
Questo modello, spesso chiamato “no-profit-no-loss”, permette all’industria di partecipare alla ricerca sulle malattie neglette. Misurazioni dei diversi approcci allo sviluppo di un farmaco dimostrano che lavorando da sole sia le industrie che le istituzioni pubbliche raggiungono minor risultati rispetto alle cooperazioni tra pubblico e privato, cioè lo sviluppo di farmaci è ottimizzato con la collaborazione tra pubblico e privato.
Otto progetti (Artemotil, Paluther, estensione delle pastiglie di Coartem all’uso pediatrico, Lapdap, Biltricide, Impavido, Ornidyl e Mectizan) sono stati condotti in collaborazioni pubblico-privato (con TDR).
Alcuni di questi hanno avuto un notevole impatto sulla salute dei paesi in via di sviluppo.
Al contrario, tutti i 13 farmaci sviluppati dalle sole industrie farmaceutiche hanno avuto un basso valore, con un solo farmaco accessibile e utile nel terzo mondo.
Il maggior ostacolo a una più ampia diffusione di questi farmaci è stato l’eccessivo costo, dovuto spesso ai costosi principi attivi o agli alti costi di formulazione e la loro scarsa idoneità alla popolazione target.
Quasi la metà di tutti i progetti delle PPP (49%) e più della metà dei progetti di collaborazione con le industrie (63%) sono progetti d’avanguardia, mentre solo 8% dei progetti delle industrie che lavorano da sole lo sono. Inoltre lo sviluppo di farmaci da parte di PPP è molto più veloce di quello del settore pubblico da solo.
Il rapporto costo- efficienza delle PPP è superiore a quello degli altri approcci.
I costi di progetti che coinvolgono istituzioni accademiche, industrie di paesi in via di sviluppo e sub- appaltatori sono di solito resi pubblici e sono significativamente contenuti nella maggior parte dei casi. Per esempio il progetto di perossido sintetico di Medicines for Malaria Ventures è costato (dalla fase di ricerca iniziale fino alla fase I dei trials clinici) 11,5 milioni di dollari (il costo dell’intero progetto sarà ovviamente più alto).
Il costo industriale per sviluppare una nuova molecola per il mercato occidentale è sostanzialmente più alto ed è stato stimato dal Tufts Institute pari a 802 milioni di dollari per farmaco, incluso i costi di fallimento e del capitale e a 403 milioni di dollari per le spese per la R&D (incluso i costi di fallimento) (DiMasi et al., 2003).
Sebbene indicativi, questi costi non sono veri per lo sviluppo di tutti i farmaci per le malattie neglette, poiché alcune aziende sostengono che i loro costi sono molto più bassi a causa dei minori costi dei trials clinici effettuati nei paesi in via di sviluppo (per esempio attorno ai 50 milioni di dollari per portare una nuova molecola dalla sua scoperta all’inizio dello studio clinico).
Anche usando queste stime più basse, comunque, ci si aspetta che le PPP diano risultati migliori in termini di costi e di rapporto costo- efficienza.
Le industrie che lavorano da sole tendono a focalizzarsi su una R&D meno costosa, meno rischiosa e riadattandola a seconda delle situazioni (ad esempio estendendo all’uomo l’etichetta di farmaci ad uso veterinario o nuove formulazioni di farmaci esistenti e/o lavorando lentamente, poiché viene data la priorità dell’impiego di staff e fondi per programmi più commerciali).
Con il modello di partnership, le stesse compagnie possono contenere i prezzi e i rischi ma in un modo molto più produttivo, focalizzandosi sulla scoperta di molecole innovative, sapendo che altri sono disponibili per aiutarne lo sviluppo e la consegna ai pazienti.
Cosa significa questo per i governi?
Purtroppo c’è una chiara separazione tra la realtà dell’attività sulle malattie neglette e il modo di pensare dei governi, che si focalizza sul commercializzare la R&D per riportare le grandi compagnie sul campo.
Esiste invece una urgente necessità di supportare il modello PPP per le malattie neglette, il quale sta già consentendo la realizzazione di nuovi farmaci con un alto livello di efficienza in rapporto al costo ed è un fattore cruciale per il coinvolgimento delle industrie farmaceutiche nella R&D.
A questo proposito il G8 già nel 2005 si è impegnato ad aumentare gli investimenti diretti attraverso partnerships pubblico-privato, per incoraggiare lo sviluppo di farmaci per la cura di AIDS, malaria, TB e altre malattie neglette (DFID, 2005).
Quale speranza per il futuro?
Quale sarà il futuro delle PPP forse è ancora presto per dirlo, ma di certo si stanno dimostrando uno strumento innovativo per la ricerca sulla malattie dimenticate, correggendo, almeno parzialmente, i gravi difetti della ricerca farmaceutica puramente guidata dal mercato e portando all'attenzione dell'opinione pubblica mondiale l'essenzialità dei nuovi farmaci.
E' altrettanto vero che all'interno delle PPP è indispensabile il ruolo di organizzazioni e fondazioni no-profit, università ed istituti di ricerca pubblici, le uniche istituzioni in grado di garantire un impegno finalizzato alla reale salvaguardia del diritto alla salute per tutti.
La collaborazione con piccole e grandi compagnie farmaceutiche, spinte a collaborare da ragioni di carattere etico ed economico, non può che favorire la realizzazione dei diversi progetti, fornendo talenti e capacità essenziali per la ricerca farmaceutica.
I risultati finora ottenuti dalle PPP devono rappresentare solo l'inizio di un profondo impegno della comunità internazionale nella ricerca, ma le malattie dimenticate colpiscono principalmente i paesi più poveri ed è necessario che siano questi ultimi a poter, se non gestire, per lo meno partecipare attivamente allo sviluppo delle future soluzioni per questo grave problema.
La diffusione di tecnologie e la crescita di infrastrutture farmaceutiche nei paesi del Terzo Mondo è un passo fondamentale nella corretta evoluzione di questo campo di ricerca ed essenziale per affrontare in maniera efficace il grave problema delle malattie dimenticate.
Le PPP: Drugs for Neglected Diseases initiative (DNDi)
Il DNDi è un’organizzazione no-profit indipendente che sviluppa farmaci e altri strumenti per la salute delle persone che soffrono di malattie neglette. E’ stata fondata nel 2003 in Svizzera e intende sviluppare farmaci contro le malattie neglette unendo risorse da istituzioni del settore pubblico e da industrie farmaceutiche di tutto il mondo assicurandosi che i farmaci siano disponibili e accessibili ai pazienti più poveri.DNDi nasce dall’esigenza sollevata dall’organizzazione medico-umanitaria Medici Senza Frontiere (MSF) di analizzare le cause della crisi esistente nella ricerca e sviluppo di farmaci per le malattie neglette e di trovare una strategia innovativa per assicurare lo sviluppo di farmaci nuovi e affidabili.
DNDi era finanziato inizialmente da MSF: l’organizzazione infatti ha fornito risorse sufficienti per supportare DNDi per 5 anni, periodo durante il quale ha incominciato a raccogliere fondi pubblici e privati. DNDi si basa però principalmente sul settore pubblico poiché pensa che questo settore debba prendersi la responsabilità di impegnarsi sui bisogni dei pazienti “dimenticati”.
I finanziamenti deriveranno da istituzioni pubbliche come governi nazionali o regionali, l'Unione Europea, organizzazioni internazionali, ma anche da fondazioni private specializzate e donazioni individuali, soci fondatori di DNDi e dalla gente comune. Diversamente dalle altre PPP, DNDi vuole portare lo sviluppo di farmaci per le malattie neglette fuori dal mercato e incoraggiare il settore pubblico ad assumersi una maggiore responsabilità. Questo si riflette nella composizione dei suoi soci fondatori che include 4 grandi istituzioni pubbliche di ricerca: Oswaldo Cruz Foundation (Brasile), Indian Council of Medical Research (India), Ministero della Salute Malese, e Kenya Medical Research Institute. Completano la rosa di soci fondatori Medici Senza frontiere e l'Istituto Pasteur (Francia); DNDi inoltre collabora strettamente con il Programma Speciale UNDP-World Bank-WHO per Research and Training in Tropical Diseases (TDR).
DNDi sviluppa farmaci su basi no-profit, usando la R&D esistente, rinforzandola, in paesi in cui le malattie neglette sono endemiche. In 12 anni vuole avere 6/7 farmaci registrati. Il costo per raggiungere tale obiettivo è stato stimato attorno ai 250 milioni di dollari. Per ridurre i costi DNDi svilupperà farmaci da composti esistenti.
Infatti secondo DNDi, la scienza per queste malattie esiste ma mancano le strutture per implementarla, e questo è esattamente quello che esso fornisce.
Tutti i tipi di aziende farmaceutiche (multinazionali, compagnie nei paesi endemici e aziende biotecnologiche) possono contribuire al progetto di DNDi in vari modi, soprattutto fornendo l'accesso alle proprie banche di molecole e alle proprie capacità e partecipando al miglioramento dei progetti e degli stadi finali della produzione di farmaco (Fonte: dndi.org).
Le multinazionali farmaceutiche: Novartis
Ai programmi volti a favorire e sostenere l'accesso ai farmaci nel mondo, Novartis destina investimenti molto consistenti. Nel 2006 l'impegno finanziario su questo fronte ha raggiunto i 755 milioni di dollari, cifra pari a oltre il 2% del fatturato globale del gruppo. I pazienti che ne hanno beneficiato sono stati quasi 34 milioni.Nel 2003, in collaborazione con l'Economic Development Board di Singapore, è stato fondato il Novartis Institute for Tropical Diseases (NITD), centro che studia nuove terapie per curare febbre dengue, tubercolosi, malaria e lebbra, malattie dimenticate ma non rare, che falcidiano ogni anno milioni di persone nei paesi poveri.
Nello sviluppo dei programmi di ricerca del Novartis Institute hanno un ruolo decisivo le partnership con organizzazioni internazionali, istituti di ricerca, università, istituzioni pubbliche.
Nel 2006 il centro ha promosso, in collaborazione con il Wellcome Trust, l’Economic Development Board of Singapore e il Medicines for Malaria Venture, un importante progetto per una nuova generazione di farmaci contro la malaria. Ben il 40% della popolazione mondiale è a rischio malaria: ogni anno ne sono colpite 250 milioni di persone, con oltre un milione di morti.
L'area di gran lunga più esposta alla malattia è l'Africa sub-sahariana, dove si registra la maggior parte dei decessi: ogni 30 secondi un bambino muore di malaria. La recrudescenza della malaria, che si è registrata negli ultimi anni, si deve allo sviluppo, nel parassita che genera la malattia, di una resistenza genetica ai farmaci antimalarici tradizionali. Se un paziente interrompe la terapia prima che tutti i parassiti della malaria siano stati debellati, quelli sopravvissuti avranno la capacità di colonizzare di nuovo l'organismo.
Questo ha reso progressivamente inefficaci monoterapie come la clorochina e il Fansidar che, per molti anni, sono stati trattamenti di riferimento per la malattia.
Dalla collaborazione tra Novartis e partner cinesi è stata realizzata una terapia combinata a base di artemisinina (ACT) che sopprime totalmente il parassita della malaria riducendo drasticamente la possibilità che questo sviluppi delle resistenze. Il farmaco si chiama Coartem ed è stato riconosciuto dall'Organizzazione Mondiale della Sanità come il più efficace per contrastare l'espansione della malaria farmaco-resistente.
A conferma di ciò, il Fondo Globale per la lotta ad AIDS, tubercolosi e malaria ha recentemente garantito una fornitura biennale di Coartem a sette nazioni africane, attraverso un finanziamento di 170 milioni di dollari. Per far fronte al crescente fabbisogno di Coartem nel Sud del mondo, in questi ultimi anni, Novartis ha incrementato enormemente la produzione del farmaco fino a raggiungere attualmente i 100 milioni di trattamenti e nel 2006 ha ridotto ulteriormente il prezzo di Coartem, mettendolo a disposizione sotto costo.
In occasione dell'Africa Malaria Day 2007, Novartis ha donato 4,7 milioni di trattamenti alla Tanzania, Paese nel quale la malaria è la principale causa di morte.
Gli sforzi che Novartis compie in ricerca sono però minacciati dalle carenze nelle infrastrutture e dalla discontinuità dei trattamenti, come avviene per esempio con le cure per la tubercolosi (TB). In questi ultimi anni, il numero di persone contagiate è aumentato vertiginosamente sia nei Paesi in via di sviluppo che in quelli industrializzati e ogni anno 2 milioni di persone muoiono a causa di questa malattia.
La terapia esistente dura sei mesi e prevede la combinazione di più farmaci: i sintomi scompaiono già dopo i primi due mesi di trattamento ma, proprio per questo, i pazienti tendono a interrompere la cura. Questo rappresenta un grande problema perchè provoca l’insorgere di resistenza ai farmaci.
Ogni anno si registrano 450mila nuovi casi di TB farmaco-resistente; questa forma della malattia può essere curata ma il suo trattamento è difficile: i farmaci costano fino a 100 volte di più e hanno un grado di tossicità più elevato. Per sviluppare trattamenti innovativi contro la tubercolosi farmaco-resistente, il NITD si affiderà alle nuove tecnologie genomiche e bioinformatiche. Gli eventuali farmaci messi a punto verranno resi disponibili nei Paesi dove la TB è endemica, senza far pagare loro alcuna royalty.
(Si ringrazia per queste informazioni la Dott.ssa Xxxxxxxxx Xxxxxxx, Communication Trainee, Novartis Farma S.p.A.).
Una voce fuori dal coro: Medici Senza Frontiere
Opinioni diametralmente opposte a quelle di Novartis vengono sostenute fortemente dall'organizzazione medico-umanitaria internazionale Medici Senza Frontiere (MSF). Secondo MSF, infatti,“nessuno dei nuovi farmaci contro la TB attualmente allo studio potrà offrire una soluzione in tempi rapidi.Per questo motivo MSF chiede all'OMS di farsi promotrice di un'azione che riconosca la priorità della lotta alla TB e in particolare alle forme resistenti ai farmaci.
MSF cura 17mila pazienti affetti da TB in 94 progetti distribuiti in 44 Paesi e assiste un numero sempre crescente di casi di TB resistente ai farmaci. La risoluzione approvata a maggio 2006 dall'assemblea generale dell'OMS riconosce la necessità di cambiare le dinamiche che fin qui hanno lasciato la ricerca medica nelle mani delle sole industrie private che necessariamente tralasciano le malattie dei più poveri.
MSF chiede dunque all'OMS di agire in prima persona destinando adeguati finanziamenti alla ricerca contro questa malattia e smettendo di delegare la responsabilità dello sviluppo di nuovi farmaci alle diverse partnership pubblico-private e filantropiche”.
MSF ritiene inefficaci anche le soluzioni proposte dai leader del G8, che si sono riuniti in Germania l'8 giugno 2007. In quella sede è stata annunciata la volontà di intensificare gli sforzi per la lotta alle pandemie in Africa mediante la promessa di stanziare 60 miliardi di dollari nei prossimi anni.
Secondo Medici Senza Frontiere, infatti, “ammesso che la promessa venga mantenuta, l’efficacia di questi fondi aggiuntivi sarà gravemente compromessa dalla contemporanea scelta di mantenere artificialmente alti i prezzi dei farmaci tramite il rafforzamento della proprietà intellettuale”. L’annuncio dello stanziamento di 60 miliardi è stato infatti preceduto da una decisione che mira a imporre ai Paesi emergenti limiti più stringenti alla produzione di farmaci in grado di fare concorrenza a quelli delle multinazionali occidentali.
Paesi come l’India, il Brasile e la Tailandia sono importanti produttori di versioni generiche di alcuni farmaci essenziali ampiamente utilizzati nei paesi in via di sviluppo. Medici Senza Frontiere si prende cura di oltre 80000 malati di AIDS in oltre 30 Paesi: l’80% dei farmaci utilizzati dall’associazione umanitaria sono prodotti in India.
“MSF - come molte altre istituzioni internazionali - sceglie i farmaci indiani perché la loro qualità è certificata dall’Organizzazione Mondiale della Sanità e hanno costi molto più contenuti rispetto a quelli delle multinazionali.
Per adottare politiche in favore dell’Africa, i leader del G8 dovranno riaffermare il diritto dei Paesi a utilizzare tutte le clausole di salvaguardia previste dagli accordi internazionali sul commercio di farmaci e soprattutto le licenze obbligatorie che permettono ai Paesi in stato di necessità di bypassare legittimamente i brevetti sui farmaci per produrre versioni generiche di qualità e a basso costo” (Fonte: msf.it).
Non è dello stesso parere Novartis che il 23 febbraio 2007 ha intrapreso un’azione legale contro il Governo Indiano a seguito della decisione dell'Indian Patent Office di respingere la richiesta per la concessione di brevetto al Glivec, innovativo farmaco contro il cancro di produzione Novartis.
“In India, come in altri Paesi emergenti, esiste di fatto un doppio mercato e Novartis adotta di conseguenza una strategia differenziata, sempre orientata ai pazienti” sostengono i portavoce della casa farmaceutica. “Novartis, così, è ben consapevole delle esigenze dei pazienti indigenti e, per questo, fornisce loro gratuitamente Glivec; allo stesso tempo, ha una grande considerazione dell’India economicamente emergente, che è in una fase di grande sviluppo economico, con tutti i diritti e i doveri che questo status comporta.
In questo contesto, la tutela della proprietà intellettuale non è fattore di indebolimento dell’economia indiana, ma, al contrario, potrà rafforzarla, aiutando il Paese a diventare un importante attore nel panorama farmaceutico mondiale”.
Il 6 agosto 2007 l’Alta corte giustizia di Chennai ha respinto il ricorso Novartis teso a modificare la legge indiana sui brevetti.
Il programma di assistenza internazionale GIPAP, relativo al farmaco oncologico di Novartis Glivec, è uno dei maggiori progetti di assistenza al paziente mai realizzati al mondo.Il farmaco viene assicurato a tutti i pazienti cui è stata diagnosticata la leucemia mieloide cronica o un tumore allo stroma gastrointestinale. Novartis distribuisce il farmaco gratuitamente, o a prezzi convenzionati, ai pazienti nei Paesi in via di sviluppo che non sono in grado di sostenere il costo del trattamento o cittadini di Paesi avanzati senza adeguata copertura sanitaria.
In India più di 6.000 pazienti (il 99% di coloro a cui è stata diagnosticata la malattia) ricevono Glivec gratuitamente da Novartis. Nel mondo, sono oltre 19.000 in 80 Paesi (Fonte: novartis.com).
torna al menù
Prodotti rivalutati
Caso talidomide: ritorno e nuove opportunità di cura
La talidomide fu sintetizzata a metà degli anni ’50, e fu venduta come sedativo-ipnotico, rivolto in modo particolare alle donne per sconfiggere ansia e nausea nei primi mesi di gestazione.In pochi anni, grazie ad un’intensa campagna pubblicitaria che presentava il farmaco come sonnifero efficace ma sprovvisto di effetti collaterali, divenne un prodotto da banco largamente utilizzato.
Il pregio dell’innocuità fu confermato anche dal fatto che in molti casi l’assunzione di grandi quantità a scopo suicida non era risultata efficace. La talidomide fu così strumentalmente consigliata a tutti, persino alle donne in gravidanza. Nel 1961 questo farmaco fu ritirato dal commercio in seguito alla scoperta della teratogenicità dovuta ad uno dei suoi enantiomeri. La talidomide infatti agisce come inibitore dell’angiogenesi, ovvero al normale sviluppo dei vasi sanguigni, interferendo con lo sviluppo del feto, specie se assunto nelle prime settimane della gravidanza. Questo effetto fu reso tristemente evidente con la nascita di migliaia di bambini (circa 2800 casi solo in Germania) che presentavano amelia (assenza degli arti) o gravi forme di focomelia (riduzione delle ossa lunghe degli arti).
Il farmaco è stato recentemente rivalutato in seguito alla dimostrazione della sua efficacia in alcune patologie rare quali l’eritema nodoso lepromatoso, una condizione riscontrata in alcuni pazienti affetti da lebbra.
La talidomide negli anni ’90 è stata impiegata negli Stati Uniti per curare la stomatite aftosa associata ad infezione da HIV.
Il 20 Marzo 1996 la Celgene Corporation ha dato ufficialmente notizia che, per la quarta volta, l’FDA ha acconsentito alla designazione della talidomide quale farmaco orfano nella cura della cachessia indotta dall’AIDS.
Nel 1998 l’EntreMed, Inc. ha annunciato di aver ottenuto dall’FDA la designazione di farmaco orfano per la talidomide, nel trattamento dei tumori primitivi del cervello. Viene così incentivata la ricerca su una forma morbosa che secondo le statistiche, interessa negli USA meno di duecentomila persone l’anno.
Dal maggio 2003 si è resa disponibile anche in Europa la Thalidomide Pharmion, ovvero una talidomide prodotta secondo gli standard di GMP (Good Manufactoring Practice) e con la disponibilità di un sistema di risk management, in tutto simile a quello messo a punto dall’FDA negli Stati Uniti. Nell’UE il Thalidomide Pharmion, prodotto dalla Pharmion Corporation, è stato designato come farmaco orfano per il trattamento del mieloma multiplo (09/07/2001).
L’effetto angiogenico rende questa molecola un ottimo candidato come farmaco anti-tumorale. La sua eventuale approvazione lo qualificherà al diritto di avere dieci anni di esclusività sul mercato in presenza delle indicazioni terapeutiche per cui è stato approvato.
La domanda di autorizzazione si basa su un pacchetto di dati clinici risultanti da quattro studi che hanno coinvolto oltre 1400 pazienti. Il Thalidomide Pharmion è approvato in Australia, Nuova Zelanda, Turchia, Israele, Corea del Sud e Tailandia per il trattamento del mieloma multiplo dopo il fallimento delle terapie standard.
Anche l’AIFA sta esaminando con attenzione l’evoluzione delle conoscenze sulla talidomide, non dimenticando quanto successo in passato, ma evitando, pur in un contesto rigoroso di risk management, di privare i pazienti oncologici di un trattamento efficace.
Il ritorno di tale farmaco in Italia è dovuto ad un’importantissima ricerca coordinata dal Dr. A. Palumbo e dal Prof. M. Boccadoro entrambi dell’ospedale “Molinette” di Torino.
La ricerca è durata cinque anni, dal 2001 al 2006.
Sono stati monitorati 255 pazienti malati di mieloma multiplo refrattario: 129 sono stati trattati secondo la terapia tradizionale con un chemiotarapico, il melfalan (nome commerciale Alkeran, GlaxoSmithKline), altri 126 sono stati curati invece con il melfalan e talidomide. Si è scoperto un effetto sinergico di questi due farmaci.
La talidomide e il melfalan somministrati singolarmente hanno dato circa il 5% di remissioni complete. Sui pazienti a cui sono stati somministrati contemporaneamente si è avuto il 30 % di remissioni complete.
Questa ricerca cambia anche le prospettive terapeutiche dei malati di mieloma, in quanto la cura è meglio tollerata ed aumenta la compliance del paziente, che assumerebbe solo 3 pastiglie al giorno rispetto alla terapia standard di più difficile somministrazione.
Questa sperimentazione ha evidenziato risultati migliori rispetto al miglior trattamento finora utilizzato, il trapianto di midollo.
Fino ad oggi la talidomide è stata distribuita negli Stati Uniti ad oltre 100.000 pazienti accompagnandola ad un sistema di risk management. In Italia non è possibile effettuare una valutazione attendibile del consumo del farmaco, in quanto esiste un’altra fonte di talidomide derivante dall’impiego del farmaco come galenico nonostante la legge “Di Bella” sancisca l’illegittimità delle preparazioni galeniche a base di talidomide.
Caso naltrexone
Il naltrexone è un antagonista dei recettori oppioidi approvato dalla FDA ed utilizzato in farmacologia per il trattamento della dipendenza da oppioidi e dell’ alcolismo (50 mg al gg). Nel 1985, il Dr. Bihari, ha scoperto che una dose inferiore di naltrexone (3 mg circa al giorno) è in grado di aumentare la proliferazione delle cellule del sistema immunitario, potenziando l’azione dei farmaci antiretrovirali in pazienti affetti da HIV/AIDS. Successivamemente ha riscontrato effetti benefici in patologie come il cancro (es. linfoma), malattie autoimmuni e disordini del sistema nervoso centrale (Binari, 1996).Secondo il Dr. Agrawal, dell’Iowa University, esistono dati a sostegno dell’ impiego di bassi dosaggi di naltrexone nel trattamento della sclerosi multipla (SC). Tale composto sembra infatti non solo prevenire le recidive di SC ma riduce anche la progressione della malattia.
Si ritiene che questo tipo di posologia agisca inibendo l’apoptosi degli oligodendrociti mediante la riduzione dell’attività dell’ossido nitrico sintasi inducibile (Agrawal, 2004). Nonostante il naltrexone sia un farmaco approvato dall’FDA, i vari usi dell’LDN (low dose naltrexone) devono ancora essere valutati per l’assenza fino a qualche anno fa di studi clinici.
La causa era l’eccessivo costo dei trials clinici rapportato alla mancanza di un adeguato ritorno economico per le industrie farmaceutiche interessate.
Per questo motivo alcuni volontari, tra cui pazienti e i medici stessi, hanno cominciato a raccogliere fondi per finanziare i trials clinici attualmente in corso: si punta ad ottenere l’approvazione dell’FDA per l’utilizzo a basso dosaggio di naltrexone (LDN) nel giro di 2-4 anni.
torna al menù
Conclusioni
Obiettivo di questo project work era raccogliere informazioni sul mondo dei farmaci orfani, ponendo l'attenzione sulle diverse accezioni che il termine può avere e mettendone in luce i punti di vista di alcuni degli stakeholders coinvolti in questo contesto, dalle grandi multinazionali, alle aziende più piccole che si dedicano interamente a questo tipo di farmaci, da alcuni enti di ricerca a carattere scientifico, fino alle associazioni dei pazienti il cui stato di salute dipende dalla disponibilità di questi farmaci.Da un'analisi delle leggi che governano ed incentivano questo mercato, dalle quali dipendono l'entità dei finanziamenti destinati alla ricerca e sviluppo per i farmaci orfani, emergono soprattutto considerazioni etiche che sollevano da una parte il problema della distribuzione delle risorse, dall'altra fanno sorgere domande sulla legittimità di tali investimenti. Spesso infatti la domanda di designazione di farmaco orfano è presentata dalle aziende farmaceutiche allo scopo di accelerare i tempi previsti per l'immissione in commercio, secondo un comportamento che prende il nome di "segmentazione degli usi terapeutici".
Conseguenza di questo atteggiamento è la comparsa di "falsi competitor", ovvero farmaci convenzionali la cui autorizzazione specifica solo nel trattamento di alcune particolari indicazioni terapeutiche gode delle agevolazioni caratteristiche dei prodotti orfani, allo scopo poi di estendere il mercato di tali farmaci secondo il principio dell'uso compassionevole.
Nonostante il quadro normativo ad oggi non sia efficace nell'evitare questo tipo di speculazione, ha comunque contribuito nel favorire l'accesso di pazienti affetti da malattie rare a cure e terapie specifiche, sensibilizzando anche l'opinione pubblica.
La ricerca delle ragioni che portano un'azienda ad investire in un simile mercato risiede infatti nella volontà di rendere equo l'accesso alle cure o nella convinzione di poter in questo modo assolvere parte della loro responsabilità sociale.
Sebbene la nostra indagine sia stata limitata ad un piccolo numero di aziende, l'impressione è che non sempre esse siano disponibili nell'affrontare questo tipo di discorso.
Al contrario le associazioni dei pazienti partecipano, in linea con i loro principi, alla diffusione dell'informazione sulle malattie rare, che seppur riguardanti un ristretto numero di pazienti hanno lo stesso bisogno di cura delle patologie largamente diffuse.
Considerata la classificazione più ampia di "farmaco orfano", definita nel capitolo 4, ci si rende conto come questo concetto si presti a diverse interpretazioni, dalle quali dipendono l'entità di diffusione della malattia, gli enti e gli organi coinvolti nel processo di incentivazione allo sviluppo di tali farmaci e le popolazioni di pazienti interessate. Proprio in relazione a queste ultime abbiamo evidenziato la disparità dei casi legati a patologie poco diffuse e malattie orfane perché dimenticate, tipiche del Terzo Mondo.
Speriamo quindi, data la vastità dell'argomento, di esser riusciti a dare una visione d'insieme che risulti, nel contempo, sintetica ma esaustiva.
torna al menù
Data ultimo aggiornamento pagina: 13/11/2012

